Химическая природа - элемент
Cтраница 2
 |
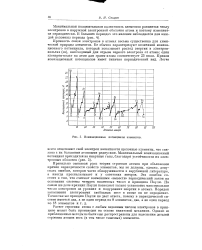
Зависимость энтальпии образования ( AW gg высших оксидов ( а и хлоридов ( б от порядкового номера элемента с положительной степенью окисления. [16] |
В соответствии с изменением химической природы элемента закономерно изменяются и химические свойства соединений, в частности их основно-кислотная активность. Так, в случае оксидов в ряду Li2O - ВеО - В2О3 - СО2 - N2O5 по мере уменьшения степени полярности связи ( уменьшения отрицательного эффективного заряда атома кислорода б) ослабляются основные и нарастают кислотные свойства: Li2O - сильно основный оксид, ВеО - амфотерный, а В2О3, СО2 и N. [17]
Из приведенных данных очевидно, что химическая природа элемента отчетливо проявляется в интенсивности кругооборотов. Подвижные, не образующие нерастворимых солей хлор, бром и иод быстро выносятся с атмосферными осадками, а прочно связанный фтор выносится в малой мере. Из этих же данных видно, что интенсивность круговорота хлора много больше, чем других галогенов. [18]
I, § 5), химическую природу элементов определяет сочетание восстановительных и окислительных свойств нейтральных атомов, количественной характеристикой которых являются значения энергии ионизации и энергии сродства к электрону, которые изменяются в зависимости от изменения заряда ядра и размеров атома: с увеличением заряда ядра энергии ионизации и сродства к электрону увеличиваются, а с увеличением радиуса атома уменьшаются. В связи с этим в периодах энергия ионизации слева направо - от щелочных металлов к инертным элементам - увеличивается, а в группах сверху вниз уменьшается. Энергия сродства к электрону, вообще изменяющаяся симбатно с изменением энергии ионизации, увеличивается для элементов от четвертой до седьмой главных подгрупп и резко падает при переходе от седьмой к восьмой главной подгруппе. [19]
Если учесть очень большие различия в химической природе элементов, которые могут быть центральными атомами в соединениях гексацидо-типа, становится понятно, что и сами гексацидокомплексы должны сильно различаться в отношении всей совокупности физических и химических свойств. Однако общим у них всех является наличие комплексного иона, состоящего из центрального атома и координированных кислотных остатков, в совокупности занимающих шесть координационных мест. Степень прочности этого комплексного иона, его отношение к химическим реагентам, окраска и другие свойства могут колебаться в широчайших пределах в зависимости от природы центрального атома, его заряда и природы координированных групп. Роль координированных кислотных остатков могут играть ионы: фтор, хлор, бром, иод, циан, родан, нитрит, нитрат, сульфат, карбонат, оксалат, формиат и многие другие. [20]
Если учесть очень большие различия в химической природе элементов, которые могут быть центральными атомами в соединениях гексацидо-тнпа, становится понятно, что и сами гексацидокомплексы должны сильно различаться в отношении всей совокупности физических и химических свойств. Однако общим у них всех является наличие комплексного иона, состоящего из центрального атома и координированных кислотных остатков, в совокупности занимающих шесть координационных мест. Степень прочности этого комплексного иона, его отношение к химическим реагентам, окраска и другие свойства могут колебаться в широчайших пределах в зависимости от природы центрального атома, его заряда и природы координированных групп. Роль координированных кислотных остатков могут играть ионы: фтор, хлор, бром, иод, циан, родан, нитрит, нитрат, сульфат, карбонат, оксалат, формиат и многие другие. [21]
Способность к реакциям изотопного обмена определяется химической природой элементов и их соединений. В результате реакций изотопного обмена содержание изотопа в данной химической форме ( удельная активность соединения) будет изменяться, что может привести к потере метки и должно учитываться при оценке результатов исследования с мечеными атомами. Например, удельная активность препаратов Ва14СОз, оставленных на воздухе, уменьшается вследствие изотопного обмена с углекислотой воздуха. [22]
Протоны своей совокупностью в ядре атома определяют химическую природу элемента. Изменение их числа приводит к образованию атома другого элемента. [23]
В случае магния нам не удалось проверить химическую природу образующихся элементов, которые, как мы видели, должны быть изотопами кремния и алюминия. [24]
 |
Ионизационные потенциалы элементов. [25] |
Прочность связи электронов в атомах весьма существенна для химической природы элементов. Ее обычно характеризуют величиной ионизационного потенциала, который показывает расход энергии в электрон-вольтах ( эв), необходимый для отрыва первого электрона от атома; один электрон-вольт на атом для грамм-атома соответствует 23 ккал. Кривая ионизационных потенциалов имеет типично периодический вид. [26]
На способность переходных катионов к восстановлению или окислению влияют химическая природа элемента, состояние цеолита ( уровень дегидратации и дегидроксилирования), степень обмена, катионный состав цеолита и тип структуры. [27]
Изменение числа протонов в ядре атома в корне изменяет химическую природу элемента. [28]
Изменение числа электронов в электропсйтральном атоме также не изменяет химическую природу элемента, по изменяет зарядовое состояние частицы. [29]
Изменение числа электронов в электронейтральном атоме также не изменяет химическую природу элемента, но изменяет зарядовое состояние частицы. [30]
Страницы: 1 2 3 4