Диацилпероксид
Cтраница 2
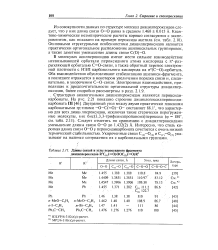 |
J. Длины Связей и углы пероксидного фрагмента диацилпероксидов R C ( ( O OOC ( 2 ( O R2. [16] |
Из совокупности данных по структуре молекул диацилпероксидов следует, что у них длина связи О-О равна в среднем 1.460 0.015 А. Основными структурными особенностями диацилпероксидов являются практически ортогональное расположение ацилоксильных группировок, а также заметное уменьшение длины связи С ( О) - О. [17]
В том случае, когда разложение диацилпероксидов, катализируемое солями меди, проводят в присутствии галогенид -, азид - или тиоциаиат-иона, конечным продуктом, как правило, оказывается алкилгалогенид, алкилазид или алкилтиоцианат, и процесс носит название внутрисферного переноса лиганда. [18]
Сравнение скоростей распада диалкилпероксидов, пероксиэфиров и диацилпероксидов показывает, что наличие у а-углерода карбонильной группы облегчает разрыв О - О-связи благодаря сопряжению образующейся свободной валентности с карбонильной группой. Вообще, влияние заместителей на процесс термолиза весьма разнообразно. Введение в ацильную часть винильных, фенильных и алкильных заместителей вызывает резкое ускорение распада. Это связано не только с индукционным влиянием заместителей, но и с изменением механизма распада от разрыва одной О - О-связи к фрагментации с одновременным разрывом двух связей в результате ослабления R-C ( O) - cвязи уже в переходном состоянии и стабилизации радикала R вследствие мезомерного и гипер-конъюгационного влияния заместителей. [19]
Карбоксильные радикалы, образующиеся при гемолитической диссоциации диацилпероксидов при 60 - 100 С, отщепляют СС2 с образованием алкильных радикалов. [20]
Карбоксильные радикалы, образующиеся при гемолитической диссоциации диацилпероксидов при 60 - 100 С, отщепляют СО2 с образованием алкильных радикалов. [21]
Наличие усреднения 8О - метки по карбонильному кислородному атому в исходном диацилпероксиде при частичном термолизе этого пероксида является прямым доказательством первоначального образования тесной радикальной пары. [22]
Диазотат-ионы 163 Диалкилбензолы 128, 159, 182 о - Диаминобензол 164 Диацетоновый спирт 250 Диацилпероксиды 375 1 2 - Дибром-2 - метилбутан 366 Дигидропиразол 394 Диены 20 ел. [23]
Данные табл. 3.6 указывают на заметную зависимость от строения заместителя прочности связи О-О в пероксидах, которая изменяется от 126 кДж / моль в диацилпероксидах до - 200 кДж / моль в CF3OOCF3 и в элементоорганических пероксидах. [24]
Можно было бы ожидать, что введение в молекулу полярных заместителей, не изменяющих существенным образом стабильность образующегося радикала, не должно сказываться на скорости гемолиза диацилпероксидов и эфиров надкислот. [25]
Например, диацилпероксид распадается на два ацилоксиради-кала - в результате быстрых последующих превращений которых образуются метан, этан, уксусная кислота, метилацетат. Скорость всего процесса определяет - первая стадия распада пероксида. [26]
Из совокупности данных по структуре молекул диацилпероксидов следует, что у них длина связи О-О равна в среднем 1.460 0.015 А. Основными структурными особенностями диацилпероксидов являются практически ортогональное расположение ацилоксильных группировок, а также заметное уменьшение длины связи С ( О) - О. [27]
Наиболее подробно исследовано разложение диацилпероксидов, катализируемое солями меди. В первой стадии из диацилпероксида получается радикал, который затем окисляется до карбокатиона. [28]
Однако в обоих случаях жесткие кислотные условия могут вызывать перегруппировки, например при обработке трифтор-перуксусной кислотой из 1 2 3 4-тетраметилбензола получен 2 3 4 6-тетраметилфенол. Сходное поведение характерно и для других диацилпероксидов. [29]
Очевидно, что аналогичное влияние эти заместители оказывают и на распад диацилпероксидов. [30]
Страницы: 1 2 3 4