Диацилпероксид
Cтраница 3
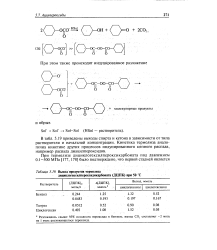 |
Выход продуктбв термолиза. [31] |
В табл. 5.19 приведены выходы спирта и кетона в зависимости от типа растворителя и начальной концентрации. Кинетика термолиза аналогична кинетике других процессов индуцированного цепного распада, например распада диацилпероксидов. [32]
Источником свободных радикалов могут быть разнообразные окислительно-восстановительные системы, в которых радикалы образуются в результате процессов одноэлектронного переноса. Например, следы восстановителей ( солей меди, никеля, железа, серебра) сильно ускоряют разложение диацилпероксидов. [33]
КС ( О) ООН ( пероксикислоты, надкислоты, перкислоты); пероксиэфиры КС ( О) ООК; диацилпероксиды КС ( О) ООС ( О) К; эфиры моно - и ди-пероксиугольной к-т КОС ( О) ООК и ( КОО) 2 СО; пероксиди-карбонаты КОС ( О) ООС ( О) ОК; алкилпероксикарбаматы КООС ( О) МНК; ге-м-дипероксиды КК С ( ООК) 2; циклич. [34]
В ИК-спектрах полосы поглощения связей СО, как правило, являются одними из самых интенсивных. Они проявляются в области 1750 - 1760 см 1 в пероксиэфирах, 1740 - 1760 см 1 в пероксикислотах и 1760 - 1815 см 1 в диацилпероксидах. Именно поэтому практически все аналитические работы по изучению ацилпероксидов с использованием ИК-спектроскопии выполнены в области карбонильного поглощения, высокохарактеристичной для ИК-спектрограмм, однако несущей лишь косвенную информацию о свойствах пероксидной связи. [35]
Хотя диацилпероксид является кислородным аналогом гекса-1 5-диена, ППЭ термоизомеризации пероксида резко контрастирует с ППЭ перегруппировок Коупа и Кляйзена. Согласованные [3,3] - и [1,3] - сигма-тропные сдвиги не могут конкурировать с перегруппировкой через а-ацил-окси-радикальную пару, образование которой следует признать наиболее вероятной причиной рандомизации 8О - метки в диацилпероксидах. [36]
Диазолид угольной кислоты ( 92) отличается очень высокой реакционной способностью по отношению к нуклеофильным реагентам из-за влияния двух электроноакцептор-ных групп с обеих сторон карбонильной функции. Вариируя нуклеофилы, реакцию переаци-лирования можно использовать в синтезе сложных эфиров, амидов, гидразидов, гидроксамовых кислот, пептидов, ангидридов, ацилгалогенидов, эфиров пероксикислот, С-ацилтрифенилфосфин-алкенов и диацилпероксидов. [37]
Диацилпероксиды образуют радикалы как при термическом, так и при фотохимическом разложении [ уравнение ( 6) ], однако для генерации вторичных и третичных алкильных радикалов предпочитают использовать фотолиз, поскольку при этом не возникают конкурентные гетеролитические реакции. Это уменьшает ценность таких соединений как специфического источника арильных радикалов, но не как инициаторов общего назначения. Аналогично диацилпероксидам разлагаются пероксиэфиры, в особенности удобны пероксалаты и перо-ксидикарбонаты, поскольку они разлагаются с удовлетворительными скоростями при 40 - 50 С, давая более реакционноспособные радикалы, чем азосоединения, например азобисизобутиронигрил, разлагающийся в той же области температур. Термическое разложение пероксидов не всегда имеет первый порядок; во многих системах они расходуются также в бимолекулярных индуцируемых радикалами реакциях. [38]
В молекулах ацилпероксидов имеют место сильное взаимодействие несвязываюшей орбитали пероксидного атома кислорода с л - разрыхляющей орбиталъю С-О - связи, а также обратный перенос электронной плотности с НЭП карбонильного кислорода на ст ( С-О) - орбиталь. Оба взаимодействия обусловливают стабилизацию ацилокси-фрагмента, а последнее отражается в некотором увеличении порядка связи и, следовательно, в укорочении С-О - связи. Электронные взаимодействия, приводящие к предпочтительности ортогональной структуры диацилпероксидов, более подробно рассмотрены в разд. Структурно аналогичными диацилпероксидам являются пероксиди-карбонаты. Следует отметить по сравнению с диацилпероксидами уменьшение длины связи О-О до 1.432 ( 2) А. Интересно, что столь короткая длина связи О-О у пероксидикарбоната сочетается с очень низкой термической стабильностью. Укороченные связи С () - О ( 2) и С ( П - О ( Г) указывают на наличие сопряжения их с карбонильными группами. [39]
Так, энергия активации распада дибензоилпероксида равна 126 кДж / чоль. Эфиры надкислот по стабильности занимают промежуточное положение между дналкил - и диацилпероксидами. [40]
Соединения с активной карбонильной группой мешают определению воды, образуя при взаимодействии с метанолом ацетали и кетали. Влияния карбонильной группы можно избежать, добавляя цианистый водород, который образует циангидрины, не мешающие определению. Из других веществ, оказывающих мешающее действие, можно назвать меркаптаны и некоторые амины, реагирующие с иодом, а также различные окислители, такие как пероксид-ные кислоты, диацилпероксиды и хиноны, реагирующие с иодидом с образованием свободного иода. [41]
При этом авторы опираются на известное и рассмотренное нами в гл. Авторы рассматривают изменение прочности связи О-О при последовательном введении в бирадикал О-О водорода, гидроксила, алкил-радикалов, ацил-радикалов, получая соответственно НООН, полиоксиды, гидропероксиды, пероксиды, перокси-кислоты, диацилпероксиды, пероксиэфиры. [42]
В молекулах ацилпероксидов имеют место сильное взаимодействие несвязываюшей орбитали пероксидного атома кислорода с л - разрыхляющей орбиталъю С-О - связи, а также обратный перенос электронной плотности с НЭП карбонильного кислорода на ст ( С-О) - орбиталь. Оба взаимодействия обусловливают стабилизацию ацилокси-фрагмента, а последнее отражается в некотором увеличении порядка связи и, следовательно, в укорочении С-О - связи. Электронные взаимодействия, приводящие к предпочтительности ортогональной структуры диацилпероксидов, более подробно рассмотрены в разд. Структурно аналогичными диацилпероксидам являются пероксиди-карбонаты. Следует отметить по сравнению с диацилпероксидами уменьшение длины связи О-О до 1.432 ( 2) А. Интересно, что столь короткая длина связи О-О у пероксидикарбоната сочетается с очень низкой термической стабильностью. Укороченные связи С () - О ( 2) и С ( П - О ( Г) указывают на наличие сопряжения их с карбонильными группами. [43]
Когда молекула распадается с разрывом только одной связи, возможна рекомбинация в клетке с образованием исходной молекулы. Это приводит к тому, что экспериментально наблюдаемая величина kp уменьшается с увеличением вязкости. В работе [12] такая зависимость получена для ряда перэфиров, диацилпероксидов, некоторых азосоеди-нений. Если энергетически более выгоден одновременный разрыв двух или более связей, то имеет место согласованный распад. [44]
Совершенно очевидно, что реакции с участием пероксидов и супероксидов требуют дальнейшего тщательного изучения, прежде чем будет окончательно выяснен их механизм. Диспропорциониро-вание системы трег-бутилгидропероксид / 98 / о-ный Н2О2 в бензоле с образованием супероксида, дающего О2, проходит с выделением протонов. Так же осуществляется диспропорциониро-вание Н2О2, катализируемое основанием. В ацетонитриле перокси-анионы реагируют с растворителем, давая в конечном счете ацетамид. Реакции супероксидов с диацилпероксидами, хлор-ангидридами и ангидридами карбоновых кислот проходят очень сложно, однако при этом в реакционной системе генерируются промежуточные продукты, способные образовывать эпоксиды из олефинов. Использование в качестве катализатора аликвата 336 вместо 18-крауна - 6 увеличивает скорость реакции, однако снижает выход эпоксидов. [45]
Страницы: 1 2 3 4