Проколлаген
Cтраница 4
Имеются экспериментальные доказательства того, что при цинге нарушено образование коллагена. Установлено, что в костях авитаминозных морских свинок количество коллагена значительно уменьшается. Кроме того, в коже больных животных содержится в 2 раза меньше проколлагена, чем в норме. Нарушения в синтезе коллагена и проколлагена, важнейших внеклеточных белков, играющих роль цементирующих и опорных структур в организме, имеют большое значение в развитии цинги. [46]
Имеются экспериментальные доказательства того, что при цинге нарушено образование коллагена. Установлено, что в костях авитаминозных морских свинок количество коллагена значительно уменьшается. Кроме того, в коже больных животных содержится в 2 раза меньше - проколлагена, чем в норме. Нарушения в синтезе коллагена и проколлагена, важнейших внеклеточных белков, играющих роль цементирующих и опорных структур в организме, имеют большое значение в развитии цинги. [47]
По своему аминокислотному составу проколлагены отличаются от коллагена главным образом содержанием тирозина, фенилаланина, гистидина, пролина и оксипролина. Содержание фенилаланина в проколлагенах приблизительно вдвое меньше, чем в коллагене, содержание же гистидина в проколлагенах, наоборот, значительно выше. Проколлагены нерастворимы в чистой воде и сравнительно слабо растворимы в подкисленной воде и в кислых буферных растворах с невысокой концентрацией солей. [48]
 |
Схема строения яичного альбумина. [49] |
Характер связей одинаков в фибриллярных и глобулярных белках. Молекулярный вес обоих основных структурных видов белка также примерно одинаков ( от 30000 до 1000000 и более), но форма значительно отличается. У фибриллярных белков длина макроглобул в сотни и тысячи раз превышает их толщину: так, макроглобула проколлагена с молекулярным весом 680000 имеет длину 3000 А при толщине несколько ангстрем. Глобулярные белки имеют чаще не шарообразную, а веретенообразную форму, варьирующую у разных белков. [50]
По своему аминокислотному составу проколлагены отличаются от коллагена главным образом содержанием тирозина, фенилаланина, гистидина, пролина и оксипролина. Содержание фенилаланина в проколлагенах приблизительно вдвое меньше, чем в коллагене, содержание же гистидина в проколлагенах, наоборот, значительно выше. Проколлагены нерастворимы в чистой воде и сравнительно слабо растворимы в подкисленной воде и в кислых буферных растворах с невысокой концентрацией солей. [51]
 |
Схема микрокалоримотра типа Кальве. [52] |
На этом основании можно предположить, что при охлаждении желатины вновь образуется одна треть разорванных при денатурации связей. Калориметрические исследования тепловой денатурации проколлагена показали [115], что вместе с тем типом структур, которые имеются в нативном проколлагене и интенсивно плавятся в области 30 - 34 и 35 - 39 С, в охлажденном денатурированном проколлагене-желатине возникают структуры нового типа, значительно менее устойчивые с более растянутым интервалом нлавления ( 23 - 31 С), совпадающим с температурным интервалом плавления гелей желатины. Меньшая степень кооперативное процесса плавления свидетельствует о меньшей степени упорядоченности структуры желатины. Величины тепловыделения, полученные тем или иным способом ( непосредственно по теплотам плавления или рассчитанные из температур плавления), составляли несколько десятков килограммкалорий на моль. [53]
Имеются экспериментальные доказательства того, что при цинге нарушено образование коллагена. Установлено, что в костях авитаминозных морских свинок количество коллагена значительно уменьшается. Кроме того, в коже больных животных содержится в 2 раза меньше проколлагена, чем в норме. Нарушения в синтезе коллагена и проколлагена, важнейших внеклеточных белков, играющих роль цементирующих и опорных структур в организме, имеют большое значение в развитии цинги. [54]
Имеются экспериментальные доказательства того, что при цинге нарушено образование коллагена. Установлено, что в костях авитаминозных морских свинок количество коллагена значительно уменьшается. Кроме того, в коже больных животных содержится в 2 раза меньше - проколлагена, чем в норме. Нарушения в синтезе коллагена и проколлагена, важнейших внеклеточных белков, играющих роль цементирующих и опорных структур в организме, имеют большое значение в развитии цинги. [55]
К первым относятся нерастворимые белки, выполняющие защитные функции и отличающиеся волокнистым ориентированным строением. Макромолекулы этих белков имеют компактную третичную структуру, приближающуюся к шару или эллипсоиду вращения. Однако такое различие весьма относительно, и между этими двумя классами существует много растворимых белков, третичная структура которых имеет смешанный характер. К их числу относятся, например, проколлаген, фибриноген и миозин. Хотя молекулы этих белков и отличаются вытянутой палочкообразной формой, их полипептидные цепи не растянуты, а свернуты в топологически сложную третичную структуру. [56]
Синтез специфических белков, характерных для позвоночных животных, имеет свои особенности, которые связаны с их структурой и определяются механизмами образования de novo белковой молекулы. Ионизирующие излучения изменяют синтез специфических белков, обеспечивающих весьма важные функции организма; Нередко нарушается сопряжение синтеза составных частей сложных белковых комплексов. При лучевой болезни заметно страдают синтез некоторых соединительнотканных структур и антителообразование. Облучение крыс в дозе 167 7 мКл / кг ведет к прогрессирующему снижению включения 14С - глицина в проколлаген кожи: через 24 ч после облучения включение метки уменьшалось в 2 раза, а через 6 сут - в 5 - 6 раз. Облучение вызывает изменение нормальных соотношений белково-углеводных компонентов соединительной ткани. [57]
На этом основании можно предположить, что при охлаждении желатины вновь образуется одна треть разорванных при денатурации связей. Калориметрические исследования тепловой денатурации проколлагена показали [115], что вместе с тем типом структур, которые имеются в нативном проколлагене и интенсивно плавятся в области 30 - 34 и 35 - 39 С, в охлажденном денатурированном проколлагене-желатине возникают структуры нового типа, значительно менее устойчивые с более растянутым интервалом нлавления ( 23 - 31 С), совпадающим с температурным интервалом плавления гелей желатины. Меньшая степень кооперативное процесса плавления свидетельствует о меньшей степени упорядоченности структуры желатины. Величины тепловыделения, полученные тем или иным способом ( непосредственно по теплотам плавления или рассчитанные из температур плавления), составляли несколько десятков килограммкалорий на моль. [58]
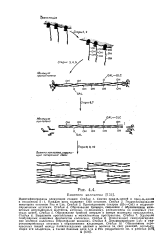 |
Биогенез коллагена.. [59] |
Каждая цепь содержит 1300 остатков. Образование трнмера, связанное с образованием межцепных дисульфидных мостиков, которые, по-видимому, расположены на концевых участках цепей. Образование тройной спнралн в центре молекулы проколлагена. [60]
Страницы: 1 2 3 4