Промотирование - электрон
Cтраница 1
Промотирование электронов возможно при условии, что пром не превышает той энергии, которая выделяется при образовании связей возбужденным атомом. Например, промотирование электрона с 2s - на 2р - АО в атоме Be ( Is3 2s2 - - ls2 2s1 2 / j1) требует затраты энергии, равной 264 кДж / моль. Однако при образовании двух связей возбужденным атомом выделяется 922 кДж / моль, что с большим избытком компенсирует энергию промотирования и делает его энергетически выгодным. В результате атом фтора образует только одну связь за счет одного неспаренного электрона, который он имеет в основном состоянии, а неон и гелий, в атомах которых отсутствуют неспаренные электроны, химических связей не образуют. [1]
Сравните возможности промотирования электронов в атомах азота, кислорода и фтора с теми же возможностями в атомах аналогов по группе, например, фосфора, серы и хлора. [2]
Что называют промотированием электронов и энергией промотирования. Чем эта энергия компенсируется. В каких случаях для атома промотирование электронов невозможно или, наоборот, энергетически выгодно. [3]
 |
Образование гибридной сферы. кроме sp К НИМ ОТНО. [4] |
Необходимость удаления либо промотирования электронов, либо отвлечения их с других связей представляет собой своеобразный барьер, и совокупность гибридизирующихся орбиталей строг ится зачастую таким образом, чтобы его не преодолевать. Так, в молекулах этилена и ацетилена каждый атом С отдает на образование л-связей одну ( в С2Н4) или две ( в С2Н2) р-орбитали; оставшиеся орбитали гибридизуются, приводя к sp2 - и sp - конфигу-рациям соответственно. [5]
 |
Молекулярные орбитали для квадратно-плоскостного комплекса. Основные участвующие орбитали металла указаны в скобках. Четыре МО являются а-связы-вающими. [6] |
При большом значении Д промотирование электрона с b2g - на 6 д-орби-таль маловероятно и поэтому не происходит термического выделения R или И в виде свободного радикала или атома. Кроме того, при большом значении Д потеря энергии стабилизации кристаллическим полем в бимолекулярных реакциях замещения сравнительно велика ( см. гл. [7]
Учитывая, что энергия промотирования электрона по схеме ( см. справа) не может быть компенсирована энергией образования связи, оцените возможность получения соединений пятивалентного азота. [8]
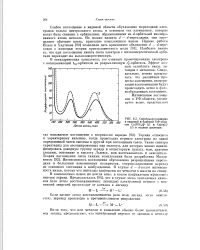 |
Спектры поглощения в видимой и близкой УФ-области Co ( NH3 ( -. и Со ( еп.. ( 2 в водном растворе. [9] |
В октаэдрических комплексах это означает промотирование электрона с несвязывающей г2г Рбитали на разрыхляющую еЦ - орбиталь. Эффект должен ослаблять связь ли-гандов с металлом. Следовательно, можно предсказать, что различные процессы замещения, изомеризации и рацемизации будут происходить легко в фотовозбужденных состояниях. [10]
Однако так же, как в СН2, здесь возможно промотирование электрона на вакантную 2р - орбиталь; при этом одновременно понижается межэлектронное отталкивание на 25-орбитали и увеличивается число электронов, способных принимать участие в связях. Рассуждая так же, как в случае СН3, мы ожидаем найти три эквивалентные sp2 - гибридные молекулярные орбитали. [11]
При этом предполагается, что возбужденное состояние п) образуется промотированием электрона с некоторой молекулярной орбитали г з0 на возбужденную, энергии которых равны Е0 и Еп соответственно. Этот тензор отличается от аналогичного тензора D, входящего в выражение для - фактора ( гл. [12]
Почему объяснение возможной валентности атома некоторого химического элемента путем сопоставления энергии промотирования электронов при переходе атома в валентное состояние и энергии возникающих химических связей не может считаться вполне обоснованным. [13]
АО, выигрыш в энергии связи за счет максимального перекрывания гибридных орбиталей часто недостаточен, чтобы компенсировать высокие затраты на промотирование электронов с низколежащих 5-орбиталей. [14]
Возможность участия З - орбиталей в связях, образуемых элементами третьего периода, связана с рядом вопросов симметрии, гибридизации и промотирования электронов с низших уровней, и влияние этих орбиталей на природу связи остается пока неясным. [15]
Страницы: 1 2 3 4