Кислотный протон
Cтраница 1
 |
Граничная структура дефекта протона в группе Н3О2 ( щелочная. [1] |
Кислотные протоны также обусловливают непрерывное поглощение в безводных растворах. Оно начинается около 3200 см 1 ( и около 2400 см 1, если присутствуют дейтероны) и простирается в сторону меньших волновых чисел. [2]
Естественно, что кислотный протон амина тем хуже обмени-ется [ или в общем случае основание I в реакции ( В. Это ил-острируется значениями рКь для уравнений ( В. [3]
Согласно кислотно-основной концепции, кислотные протоны ацетилена и метилацетилена реагируют с имеющими характер основания кислородными центрами на поверхности. Детальный механизм этого взаимодействия пока еще является спорным. При замещении протонов двумя метальными группами кислотная природа ацетилена нарушается, и л-электроны углерод-углеродной тройной связи тогда ведут себя как основание и взаимодействуют с бренстедовскими и льюисовскими кислотными центрами. [4]
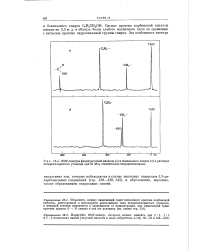 |
ЯМР-спектры фенилуксусной кислоты ( а и бензилового спирта ( б в растворе яетыреххлористого углерода при 60 Мгц относительно тетраметилсилана. [5] |
Объясните, почему химический сдвиг кислотного протона карбоновой кислоты, растворенной в неполярном растворителе типа четыреххлористого углерода, в меньшей степени изменяется в зависимости от концентрации, чем химический сдвиг протона группы О - Н спирта в тех же условиях ( см. также стр. [6]
Объясните, почему химический сдвиг кислотного протона карбоновой кислоты, растворенной в неполярном растворителе типа четыреххло-ристого углерода, в меньшей степени изменяется в зависимости от концентрации, чем химический сдвиг протона группы О - Н спирта в тех же условиях ( см. также разд. [7]
Объясните, почему химический сдвиг кислотного протона карбоновой кислоты, растворенной в неполярном растворителе типа четыреххлористого углерода, в меньшей степени изменяется в зависимости от концентрации, чем химический сдвиг протона группы О - Н спирта в тех же условиях ( см. также стр. [8]
Далее было постулировано, что если кислотный протон и его акцептор находятся в молекуле на должном расстоянии друг от друга, то каждое вкусовое окончание, ответственное за восприятие сладости, содержит пару комплементарных центров донор протона - льюисовское основание, такую, как пептидная связь - NH-С ( О) - в протеиновой цепи. Эти центры образуют сильную водородную связь со сладкой молекулой по ее протонодонорному и основному центрам, например по гидро-ксильной группе и атому кислорода сахара или глицерина. Энантиомеры простой аминокислоты - аланина - идентичны по сладости, но энантиомеры валина различаются между собой. [9]
В спектрах ПМР сульфокислот из-за влаги кислотный протон обычно не наблюдается. При очень тщательной сушке и приготовлении образцов, а также отсутствии других межмолекулярных обменных реакций этот протон удается наблюдать. [10]
Понятно, что если, зная число кислотных протонов катиона, нельзя, как в данном случае, прогнозировать стехиометрию гидратации, то возможная оценка функций кислотности на основе гидратационной модели оказывается существенно зависящей от произвольного выбора чисел гидратации. Это обстоятельство не учитывается в гидратационной модели, и, поскольку оно сильнее зависит от природы алкильных групп, чем от способности к образованию водородных связей [ 13а ], прогнозирование изменений энтропии гидратации затруднительно. По-видимому, в ближайшем будущем не приходится ожидать появления гидратационной теории, которая обладала бы предсказательной силой. [11]
Отсюда следует, что при увеличении степени гидратации кислотные протоны отрываются от анионов и могут перемещаться в гидратных структурах посредством туннельных переходов. На полосе РО-валентных колебаний при увеличении степени гидратации не наблюдается каких-либо изменений; следовательно, кислотные протоны, удаляемые от анионов, относятся к SH-группам. [12]
Наряду с основными свойствами имидазол и пиразол имеют кислотный протон и, подобно пирролу, легко образуют соли с ионами металлов. Однако имидазол и пиразол обладают несколько более сильными кислотными свойствами, благодаря электроно-акцепторному действию второго азольного азота. [13]
Титрование винной кислоты ведем до нейтрализации обоих ее кислотных протонов, так как малая разница между константами диссоциации не позволяет получить четкий скачок рН после нейтрализации первого протона. Таким образом, мы трактуем систему как однопротонную кислоту с Ка а2 но помним, что значение относительной ошибки титрования, вычисленное обычным образом, следует разделить на два. [14]
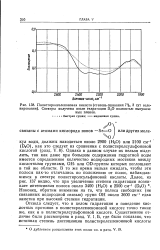 |
Полистиролселеноновая кислота ( степень сшивания 7 %, 3 сут селе-нирования. Спектры получены после гидратации D2O полностью высушен. [15] |
Страницы: 1 2 3 4