Процесс - электрохимическая коррозия
Cтраница 3
Протеканию процессов электрохимической коррозии способствует неоднородность материала, когда отдельные участки поверхности обладают различными значениями электродного потенциала. Так, из-за отдельных включений, наличия пленок, различного напряженного состояния участков поверхности возникает большое число микрогальванических элементов, генерирующих коррозионный ток. [31]
Интенсивность процесса электрохимической коррозии зависит от мнэгих факторов. Если водородный показатель рН 7, то это свидетельствует о кислой реакции среды, если рН 7, то щелочной. Непосредственное влияние рН среды на электрохимические реакции сказывается на катодных участках с водородной и кислородной деполяризацией, поскольку в этих реакциях участвуют водородные и гидроксильные ионы. На анодный процесс ионизации металла изменение водородного показателя раствора практически не влияет. [32]
Сущность процесса электрохимической коррозии заключается в том, что атомы, находящиеся в узлах кристаллической решетки металла, при контакте с раствором электролита переходят в раствор в форме ионов, оставляя эквивалентное количество электронов в металле. Переход атомов металла в ионы и растворение их в жидком электролите определяется величиной нормального электродного потенциала. Он характеризует то напряжение электрического тока, которое надо приложить к границе раздела твердого металла с жидким электролитом, чтобы воспрепятствовать переходу иона металла в раствор. Чем отрицательнее нормальный электродный потенциал, тем более резко выражено стремление металла к растворению в электролитах. Так, свинец растворяется значительно медленнее, чем железо. [33]
Кроме процессов электрохимической коррозии, наиболее широко распространенных на магистральных трубопроводах, возникают также очаги химической коррозии. Источником химических коррозионных повреждений является разрушение металла вследствие химического взаимодействия металла труб с кислородом, сероводородом, сернокислым газом и другими агрессивными компонентами, содержащимися в нефти, газе и конденсате некоторых месторождений. [34]
Сущность процесса электрохимической коррозии заключается в том, что атомы, находящиеся в узлах кристаллической решетки металла, при контакте с раствором электролита переходят в раствор в форме ионов, оставляя эквивалентное количество электронов в металле. Переход атомов металла в ионы и растворение их в жидком электролите определяется величиной нормального электродного потенциала. Он характеризует то напряжение электрического тока, которое надо приложить к границе раздела твердого металла с жидким электролитом, чтобы воспрепятствовать переходу иона металла в раствор. Чем отрицательнее нормальный электродный потенциал, тем более резко выражено стремление металла к растворению в электролитах. Так, свинец растворяется значительно медленнее, чем железо. [35]
Схема процесса электрохимической коррозии биметаллических пластин показана на рис. 14.1, а. [36]
В процессе электрохимической коррозии приобретают важное значение потенциалы равновесия между металлическим электродом и ионами металла, находящимися в растворе. [37]
В процессе электрохимической коррозии принимают участие металлы, хорошо проводящие электрический ток за счет наличия в них отрицательно заряженных частиц, так называемых свободных электронов и электролиты - водные растворы солей, кислот, щелочей, а также сама вода, проводящие электрический ток за счет наличия в них расщепленных частей положительных и отрицательных молекул - ионов. [38]
В процессе электрохимической коррозии металл может находиться в активном или пассивном состоянии. Поверхность металла постоянно обнажается и подвергается коррозии. [39]
В процессе электрохимической коррозии принимают участие металлу, хорошо проводящие электрический ток за счет наличия в них отрицательно заряженных частиц, так называемых свободных электронов, и электролиты - водные растворы солей, кислот, щелочей, а также вода, проводящие электрический ток за счет наличия в них расщепленных частей положительных и отрицательных молекул-ионов. [40]
 |
Характер изменения общего локального контактного сопротивления труба-земля в зависимости от сопротивления промежуточной анодной ( или катодной пленки. [41] |
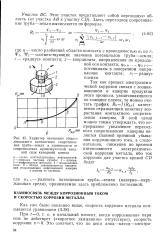
Так как процесс электрохимической коррозии связан с возникновением в каверне продуктов этого процесса, увеличивающихся по толщине пленок, то можно считать график Ro f ( Rnii) качественно отражающим кинетику возрастания контактного сопротивления каверны. [42]
 |
Диаграммы Пурбе для цинка ( о и для железа ( б.| Диаграммы Пурбе для 1а личных металлов. [43] |
Так как процесс электрохимической коррозии складывается из двух сопряженно протекающих реакций - анодной ( окисление) и катодной ( восстановление), то потенциал анодной реакции ( ионизации металла) сравнивают с потенциалом возможной катодной реакции. [44]
 |
Диаграммы Пурбе для цинка ( а и для железа ( б.| Диаграммы Пурбе дли металлов. [45] |
Страницы: 1 2 3 4