Катодный анодный процесс
Cтраница 1
Катодные и анодные процессы могут протекать на поверхности раздела металл - агрессивная среда как территориально раздельно, так и на одних и тех же участках, чередуясь во времени. Энергетически более выгодным является пространственное разделение анодных и катодных реакций, поэтому в большинстве случаев эти процессы локализуются на различных участках. [1]
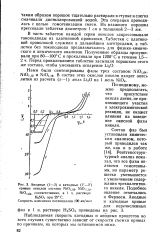 |
Анодные ( / - 3 и катодные ( 1 - 3 кривые окислов состава NiOj g, NiOjjj, NiO [ 04, соответственно, в 1 ч. растворе H2SO4 при 25 С. [2] |
Наблюдаемая скорость катодных и анодных процессов во всех случаях существенно зависит от скорости съемки кривых по причинам, на которых мы остановимся ниже. [3]
При сопряжении катодных и анодных процессов в отсутствие внешнего тока в системе устанавливается стационарное состояние, при котором абсолютные значения катодной и анодной плотности тока равны: / с 4, с а 0, а металл приобретает смешанный ( стационарный) потенциал фт. [4]
Материальный эффект катодных и анодных процессов коррозии проявляется лишь на анодах. При деполяризации водорода на катодных учает ках потеря металла места не имеет. [5]
Предположим, что катодные и анодные процессы являются сопряженными, т.е. протекают одновременно, но статистически независимо друг от друга, со скоростями, которые определяются согласно законам электрохимической кинетики общим значением потенциала на границе металл - рас-твор, составом раствора и условиями диффузии к поверхности электрода. Это предположение позволит нам, при учете того обстоятельства, что в отсутствии внешнего тока суммы скоростей всех катодных и всех анодных процессов равны между собой, получить количественные выражения как для скорости итоговой реакции, непосредственно наблюдаемой на опыте, так и для величины потенциала реагирующего металла. [6]
Для изучения кинетики катодных и анодных процессов, происходящих на стальном электроде в 0 02 М растворах нитротерефталатов натрия и гексаметиленишна ( использовали гальваностатический метод. [7]
Из величин максимальных работ катодных и анодных процессов следует, что максимальная работа процесса отрицательна и процесс самопроизвольно протекать не может. [8]
В отдельных разделах обстоятельно рассматриваются катодные и анодные процессы. Из реакций, протекающих на катоде, рассмотрено электровосстановление азотсодержащих соединений, карбонильных соединений и соединений, содержащих кратные углерод-углеродные связи. Отдельно описаны примеры электровосстановления веществ, имеющих бензойную структуру, гетероциклических соединений с кратными связями в цикле, а также реакции катодного удаления галогена и электровосстановления соединений, содержащих серу, мышьяк и другие элементы. [9]
Кроме того, пространственное разделение катодных и анодных процессов приводит, по нашему мнению, к изменению кинетики и соотношения скоростей анодных реакций растворения и образования пассивной пленки. [10]
Отдельные разделы книги посвящены описанию катодных и анодных процессов с участием органических веществ, электрохимическому синтезу элементорганических соединений, реакциям свободных радикалов, ионов и ион-радикалов, возникающих при электролизе, теории амальгамного восстановления и его препаративному использованию. [11]
 |
Схемы работы микрогальванического. [12] |
В случае гомогенного механизма коррозии металлов катодные и анодные процессы могут протекать на одном и том же участке поверхности раздела, чередуясь во времени. [13]
Возможность разделения общей реакции коррозии на самостоятельные катодные и анодные процессы является следствием существования ионов металла в растворе и свободных электронов в металле. Наличие электронной проводимости металла и ионной проводимости раствора позволяет, кроме того, протекать анодным и катодным процессам также и территориально раздельно на различных участках металла. Подобное пространственное разделение анодных и катодных процессов не безусловно необходимо для протекания электрохимического процесса, однако оно оказывается энергетически более выгодным, так как анодные и катодные процессы при этом могут локализоваться на тех участках, где они более облегчены. Поэтому в большинстве практических случаев протекание электрохимической коррозии обычно характеризуется локализацией анодного и катодного процессов на различных участках. Это является вторым важным признаком, отличающим электрохимический механизм коррозионного процесса от чисто химического. [14]
Как уже указывалось выше, в некоторых катодных и анодных процессах могут возникнуть свободные радикалы. [15]
Страницы: 1 2 3 4