Прочность - связь - электрон
Cтраница 4
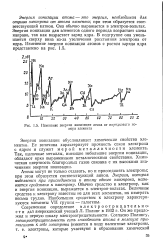 |
Изменение энергии ионизации атома от порядкового номера элемента. [46] |
Энергия ионизации обусловливает химические свойства элементов. Ее величина характеризует прочность связи электрона с ядром и служит мерой металличности элемента. Так, щелочные металлы, имеющие небольшие энергии ионизации, обладают ярко выраженными металлическими свойствами. Химическая инертность благородных газов связана с их высокими значениями энергии ионизации. [47]
 |
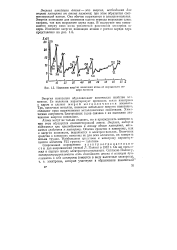
Радиальное распределение вероятности нахождения.| Значения Ъфф Для некоторых металлов. [48] |
Поэтому во внутренних областях атома, близких к ядру, вероятность нахождения даже внешних электронов достигает конечной величины. Эффект проникновения увеличивает прочность связи электрона с ядром. Эффекты экранирования и проникновения можно рассматривать с единой точки зрения, так как формально они являются способом учета взаимного влияния электронов друг на друга. [49]
 |
Изменение энергии ионизации атома от порядкового мера элемента. [50] |
Энергия ионизации обусловливает химические свойства элементов. Ее величина характеризует прочность связи электрона с ядром и служит мерой металличности элемента. Так, щелочные металлы, имеющие небольшие энергии ионизации, обладают ярко выраженными металлическими свойствами. Химическая инертность благородных газов связана с их высокими значениями энергии ионизации. [51]
 |
Радиальное распределение вероятности нахождения. [52] |
Поэтому во внутренних областях атома, близких к ядру, вероятность нахождения даже внешних электронов достигает конечной величины. Эффект проникновения увеличивает прочность связи электрона с ядром. Эффекты экранирования и проникновения можно рассматривать с единой точки зрения, так как формально они являются способом учета взаимного влияния электронов друг на друга. [53]
В атомах всех последующих элементов во второй оболочке сохраняется по 8 электронов. С увеличением заряда ядер прочность связи электронов этой оболочки увеличивается. Начиная с третьей оболочки последовательность их заполнения усложняется. [54]
В атоме электроны внешней оболочки наименее прочно связаны с ядром, что обусловлено как наибольшим удалением этих электронов от ядра, так и экранирующим влиянием силовых полей электронов промежуточных оболочек. Известно также, что прочность связи электронов внешней оболочки с ядром тем больше, чем выше степень заполнения внешнего электронного уровня электронами. [55]
В молекулах таких сложных веществ, как хлороводород НС1, связи ковалентные. Химическая природа элементов определяется прочностью связи электронов в атоме. Чем больше энергия сродства к электрону у атома элемента, тем большей способностью к оттягиванию электронов от другого атома он обладает. Так, атомы водорода уступают в этой способности атомам хлора, кислорода и азота, однако не настолько, чтобы атомы их могли полностью перетянуть электроны от атома водорода. Поэтому здесь наблюдается лишь смещение общего электронного облака к ядру атома элемента с более высокой электроотрицательностью. [56]
В данном слое электронные оболочки с меньшим / характеризуются большей электронной плотностью вблизи ядра. От распределения электронной плотности зависит прочность связи электрона в А. [57]
Страницы: 1 2 3 4