Прочность - водородная связь
Cтраница 2
На прочность водородной связи влияют: напряженность кольца, геометрия молекулы, относительная кислотность и основность групп - доноров и акцепторов протонов. [16]
Увеличение прочности водородных связей в димерах карбоновых кислот зависит от того, что они в известной степени стабилизируются резонансом. [17]
Возрастание прочности водородной связи при замене сульфат-иона на селенат-ион и, следовательно, более низкий ионизационный потенциал последнего, по-видимому, связаны с уменьшением роли 4й - орбиталей в я-связывании по сравнению с Зй-орбиталями. [18]
Как изменяется прочность водородной связи, если в молекулу фенола ввести заместители n - Cl, n - NOz, n - СНзО, га - СНз. [19]
 |
Энергия химической связи, эквивалентная поглощению квантов света различной длины волны. [20] |
С увеличением прочности водородных связей повышается стабилизирующая способность. [21]
По возрастанию прочности водородной связи анионы располагаются в ряд SOf -, Put, SiOl Эта данные коррелируют с выводом: связующие на основе сульфатов менее прочны, чем связующие на основе фосфатов и силикатов. [22]
По возрастанию прочности водородной связи анионы располагаются в ряд SO. РОЗ, SiOt Эта данные коррелируют с выводом: связующие на основе сульфатов менее прочны, чем связующие на основе фосфатов и силикатов. [23]
В некоторых случаях прочность водородных связей может приблизиться к прочности ковалентной связи. Например, ди-польный момент звеньев поливинилового спирта составляет около 1 6 D, что намного меньше дипольного момента звеньев поливи-нилиденхлорида. [24]
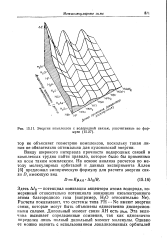 |
Энергии комплексов с водородной связью, рассчитанные по формуле. [25] |
Ввиду широкого интервала прочности водородных связей в комплексах трудно найти правило, которое было бы применимо ко всем таким комплексам. [26]
 |
Схема расположения диполей в молекулах CH3F и HF ( по Бриглебу. [27] |
Обычно считают, что прочность водородных связей убывает от HF к ОН и NH и от HF к НС1, НВг и HJ. Объясняют это различием в ноляризуемости атомов, участвующих в водородной связи. [28]
Следовательно, характер и прочность водородных связей оказывают существенное влияние на диссоциацию продукта присоединения и, следовательно, на дифференцирующие свойства растворителей. [29]
Обычно считают, что прочность водородных связей убывает от HF к ОН и NH и от HF к НС1, НВг и HJ. Объясняют это различием в поляризуемости атомов, участвующих в водородной связи. [30]
Страницы: 1 2 3 4