Прочность - водородная связь
Cтраница 3
Следовательно, характер и прочность водородных связей оказывают существенное влияние на диссоциацию продукта присоединения и, следовательно, на дифференцирующие свойства растворителей. [31]
Это соотношение зависит от прочности водородных связей, удерживающих вместе две цепи. Если водородные связи очень прочные, то разрыв молекулы произойдет только тогда, когда обе цепи порвутся в одном и том же месте. [32]
Отклонения от корреляции между прочностью водородной связи и кислотностью или основностью могут вызываться рядом факторов: поляризуемостью, способностью к образованию ковалентных связей, мягкостью донорной или акцепторной молекулы. Несмотря на то что существующие представления о зависимости между этими факторами и прочностью водородной связи ни в коем случае нельзя считать вполне обоснованными, полезной оказывается эмпирическая корреляция, основанная на разделении энтальпии образования водородной связи на электростатический и кова-лентный вклады. [33]
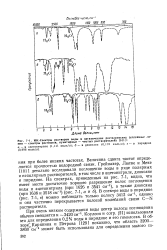 |
ИК-Спектры растворов воды в органических растворителях ( сглсшные JK-нии - спектры растворов, пунктирные - чистых растворителей. [34] |
Величина сдвига частот определяется прочностью водородной связи. Грейнахер, Лютке и Меке [101 ] детально исследовали поглощение воды в ряде полярных и неполярных растворителей, в том числе в ацетонитриле, диоксане и пиридине. В спектре воды в пиридине ( рис. 7 - 1, в) можно наблюдать только полосу 3412 см 1, однако и она частично перекрывается полосой колебаний связи С-N растворителя. [35]
Способностью к ассоциации и прочностью водородных связей и объясняются относительно высокие температуры кипения кислот по сравнению не только с углеводородами, имеющими столько же атомов углерода в молекуле, но и со спиртами. [36]
Здесь kh учитывает изменение в прочности водородной связи при замене контакта твердое тело - твердое тело на твердое тело - жидкость, а Лй-стерический фактор, отражающий процесс образования более чем одной водородной межфазной связи адсорбированной молекулы с активным центром на поверхности субстрата. [37]
Другие соображения показывают, что прочность водородной связи между молекулами воды увеличивается под влиянием кооперативных эффектов. [38]
Можно полагать, что увеличение прочности водородной связи после обработки целлюлозы растворами щелочи малой концентрации происходит только в аморфных областях целлюлозы, поскольку, согласно рентгенографическим исследованиям, при таких обработках не происходит переход целлюлозы из модификации I в II. [39]
В работе [84] дана оценка прочности водородных связей по - взаимодействию фенолов с асфальтенами, а также с фракцией, растворимой в бутаноле-2 и нерастворимой в нем. В этой же работе показано, что средние молекулярные массы асфальтенов уменьшаются с добавлением веществ, обладающих химическим сродством IK ним и имеющих относительно кислые ОН-группы, например, таких, как 2 7-нафталин-диола, 4 4-дигидрокси - 3 3-диметилдифенила, которые на 53 и 26 % реагируют с асфальтенами. [40]
Они пришли к выводу, что прочность водородной связи имеет непрерывное распределение в широком интервале. Прочность связи при изменении температуры постепенно изменяется. Каря-кин [127] для изучения состояния воды в органических и неорганических соединениях использовал ИК-спектроскопию. [41]
Более высокую основность ТГХ-производных подтверждает и прочность водородной связи с карбонилом. В этом случае, как и следовало ожидать, более прочные водородные связи в ацетоне образуют ДГХ-производные, что опять-таки согласуется с их меньшей основностью. [42]
Однако ионы вследствие поляризации могут усиливать прочность водородных связей молекул Н О, находящихся за первым гидратным слоем. В общем случае колебания комплексов не являются гармоническими Ион-водные комплексы рассматриваются как молекулярные компоненты, и для них рассчитаны числа гидратации. С увеличением ионного радиуса происходит уменьшение эффективного числа гидратации. Предполагается, что из галогенид-ионов только F - образует гидратную структуру. Большие ионы разрушают структуру воды. [43]
Это в свою очередь вызывает уменьшение прочности водородной связи с участием метанола во внутренней сфере и может вызвать исчезновение полосы I. Хотя приведенное отнесение полос является качественным и достаточно неопределенным, построенная на его основе модель структуры раствора кажегся убедительной. [44]
В обоих соединениях возможно некоторое уменьшение прочности водородной связи вследствие бекеровского резонансного эффекта, рассмотренного ниже в этом разделе. Но в дигидроксидиэтилтерефталате этот эффект выражен недостаточно и не обнаруживается спектроскопическим методом. [45]
Страницы: 1 2 3 4