Прочность - ковалентная связь
Cтраница 2
Несмотря на бесспорность того, что rf - электроны оказывают влияние на условия образования и прочность ковалентных связей, возникающих при адсорбции на металлах, нельзя ожидать простой зависимости между теплотой хемосорбции и каким-либо свойством, связанным с cf - электронами, так как хемосорб-ция зависит также от других свойств металлов. Последний член в выражении ( 32), учитывающий электроотрицательность металла, до некоторой степени характеризует легкость потери металлом электронов. Следует указать, что порядок расположения металлов по уменьшению теплот хемосорбции ( см. раздел V, 86) почти совпадает с порядком их расположения по возрастанию работ выхода. Для образования диполей с участием адсорбированных атомов и металла необходимо совершить работу против работы выхода, свойственной металлу. Поэтому можно предположить, что чем меньше работа выхода, тем меньшую работу необходимо совершить для образования этих диполей и тем больше будет дипольный момент. [16]
Приближенно ковалентность атома может быть оценена по порядку связи, являющемся в большинстве случаев косвенной характеристикой прочности ковалентной связи. Ковалентность примерно равна сумме порядков связей, образуемых этим атомом со всеми остальными атомами молекулы. Для двухатомных систем порядок связи равен полуразности числа электронов, располагающихся на связывающих МО, и числа электронов, располагающихся на разрыхляющих МО. Эти числа электронов, приходящиеся на отдельные МО, называются заселенностями орбиталей. [17]
Второй член в выражении ( 111 104) представляет собой парную заселенность, служащую хорошей характеристикой прочности ковалентной связи в молекуле. [18]
 |
Средние энергии химических связей. [19] |
Поскольку релаксация орбиталей в полярной химической связи сближает их энергии, то это приводит и к повышению прочности ковалентной связи. [20]
Изучение процесса деструкции полиметилфенилсилоксана позволяет выяснить причины разрушения полимера ранее теоретического предела термостойкости, определяемого в основном прочностью ковалентных связей гетероцепных макромолекул. [21]
Как в ряду простых веществ С-Si - Ge-Sn-Pb, в ряду изоэлектронных им соединений BN - A1P - GaAs-InSb-TIBi прочность ковалентной связи уменьшается, а возможность ее делокализации возрастает. [22]
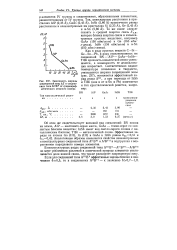 |
Зависимость ширины запрещенной зоны Д. в соединениях типа AIHBV от среднеарифметического атомного номера. [23] |
Как в ряду простых веществ С-Si - Ge-Sn-Pb, в ряду изоэлектронных им соединений BN - А1Р - GaAs-InSb - TIBi прочность ковалентной связи уменьшается, а возможность ее делокализа-ции возрастает. [24]
Изучение процесса деструкции полиметилфенилсилоксана позволяет выяснить причины разрушения полимера при нагревании до температуры, меньшей теоретического предела термостойкостиг определяемого в основном прочностью ковалентных связей гетеро-цепных макромолекул. [25]
 |
Изменение координации поверхностных центров. [26] |
Изменение валентности требует дополнительной энергии ( большой по сравнению с эффектами кристаллического поля), которую нельзя рассчитать достаточно точно, а прочность ковалентной связи сильно зависит, в числе других причин, от положения энергетических уровней. [27]
 |
Зависимость ширины запрещенной зоны ДЕ в соединениях типа А п Bv от среднеарифметического атомного номера. [28] |
Как в ряду простых веществ С - Si - Ge - Sn - Pb, в ряду изоэлектронных им соединений BN - А1Р - GaAs - InSb - TIBi прочность ковалентной связи уменьшается, а возможность ее делокализа-ции возрастает. [29]
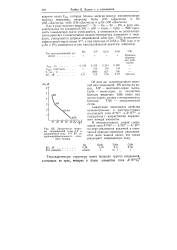 |
Зависимость ширины запрещеннЬй зоны Д Е в соединениях типа Am Bv от среднеарифметического атомного номера. [30] |
Страницы: 1 2 3 4