Прочность - ковалентная связь
Cтраница 4
Это соотношение является следствием минимума потенциальной энергии. При ковалентных связях энергетически выгоднее использовать небольшое число имеющихся связей, так как попытка присоединения дополнительных атомов приводит к повышению потенциальной энергии из-за отталкивания атомов. В этом и проявляется насыщенность связей. О прочности ковалентных связей можно судить по кристаллу алмаза, который обладает наибольшей твердостью среди всех твердых тел и наименьшим координационным числом с4, при котором еще возможно построить трехмерную координационную структуру. Конфигурации, образуемые ковалентно-связаннымн атомами, при значениях валентности v - 1, 2, 3, 4 удовлетворяют принципу рыхлой упаковки частиц. [46]
Веществ, обладающих атомными решетками, сравнительно мало. К ним принадлежат алмаз, кремний и некоторые неорганические соединения. Эти вещества характеризуются высокой твердостью, они тугоплавки и нерастворимы практически ни в каких растворителях. Такие их свойства обусловлены прочностью ковалентной связи. [47]
Веществ, обладающих атомными решетками, сравнительно мапо. К ним принадлежат алмаз, кремний и некоторые неорганические соединения. Эти вещества характеризуются высокой твердостью ( алмаз - самое твердое естественное вещество), они тугоплавки и нерастворимы практически ни в каких растворителях. Такие их свойства обусловлены прочностью ковалентной связи. Попытка сдвига одних участков кристаллической решетки относительно других приводит при достаточном усилии к ее разрушению, что связано с разрывом ковалентных связей, обладающих направленностью. Количество ближайших частиц в кристаллической решетке, окружающих выбранную, называется координационным числом. Координационное число в атомных решетках определяется числом ст-связей центрального с окружающими его атомами и, в силу насыщаемости ковалентной связи, не достигает больших значений. [48]
Он может представлять собой ограниченную группу из определенного числа молекул или сложное образование вытянутой формы, подобной форме полимера. Эту объемистую структуру саму можно рассматривать как молекулу, которая вместе с другими молекулами составляет структурную единицу, обеспечивающую захват молекулы-гостя при образовании клатратного соединения. Однако последние связаны более прочно, чем если бы они были связаны толька ван-дер-ваальсовыми силами. При этом прочность клеток зависит от прочности водородных и ковалентных связей. [49]
При обработке аммиаком спиртового раствора хлорида олова ( 1У) образуется обильный осадок хлорида аммония, но после фильтрования не получается алкоксид onoBa ( IV) нужной чистоты. Образующийся при этом сложный продукт содержит заметные количества хлорида и аммиака ( или амида) и его нельзя очистить вакуумной дистилляцией. Причины такого поведения не ясны, но присутствие хлорида в этом случае не может быть обусловлено основностью алкоксидов олова ( IV), так как последние являются кислотами Льюиса и титруются алкоксидами щелочных металлов. Возможно, сольволиз алкоксидов хлорида олова ( 1У) происходит не до конца вследствие прочности ковалентной связи Sn - С1, и по этой же причине не заканчивается также реакция с аммиаком. [50]
Для индивидуального соединения энергию все сил межмолекулярного взаимодействия называют энергией когезии. Когезия - сцепление частиц вещества ( ионов, атомов, молекул), составляющих одну фазу, обусловленное межмолекулярным взаимодействием. Количественной характеристикой когезии служит плотность энергии когезии ( ПЭК); она эквивалентна работе удаления находящихся в единице объема молекул на бесконечно большое расстояние друг от друга. У полимеров в отличие от низкомолекулярных соединений из-за большой длины цепей суммарный эффект всех сил межмолекулярного взаимодействия оказывается очень высоким, и энергия когезии будет больше энергии прочности отдельных ковалентных связей в макромолекуле. При нагревании легче разорвать макромолекулы, чем оторвать их друг от друга. [51]
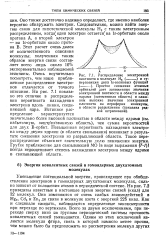 |
Распределение электронной плотности в молекуле Н2 ( - - - - - - - - и су. [52] |
Уменьшение потенциальной энергии, происходящее при обобществлении электронов в гомоядерных двухатомных молекулах, сильно зависит от положения атомов в периодической системе. На рис. 7.2 приведены известные в настоящее время энергии связей ( ккал) для 32 молекул. Они изменяются от очень слабых взаимодействий в Hg2, Cd2 и Zn2 до связи в молекуле азота с энергией 225 ккал. Как и следовало ожидать, наблюдаются определенные закономерности при переходе по вертикали. Всего за двумя исключениями, при переходе сверху вниз по группам периодической системы прочность ковалентных связей уменьшается. [53]
В алмазоподобных веществах это отчетливо проявляется. Достаточно привести пример двух веществ изоэлектронного ряда - селенида цинка и арсенида галлия. У этих веществ температуры плавления примерно одинаковы, но микротвердость селенида цинка по крайней мере в пять раз меньше микротвердости арсенида галлия. Можно думать, что микротвердость характеризует прочность именно ковалентных связей, поэтому она падает в изоэлектронных рядах. Сложный характер изменения температуры плавления в изоэлектронных рядах связан с тем обстоятельством, что при достижении жидкого состояния не все связи в одинаковой степени разрываются для разных веществ этого ряда. Энергия атомизации веществ в изоэлектронных рядах, по-видимому, также характеризует прочность ковалентных связей. [54]
Если при рассмотрении атомных состояний существенным было обращение к свойствам стоячих волн, то при обсуждении вопроса о связывании атомов столь же важно обратиться к другому общему свойству волн, называемому резонансом. В механике резонанс наблюдается в тех случаях, когда две системы, в которых могут возникнуть идентичные стоячие волны, связаны или способны до известной степени взаимодействовать между собой. При этом стоячая волна одной из систем возмущает другую систему, в результате чего сама перестает быть стоячей. Таким образом, устанавливается единая система двух новых стоячих волн, одна из которых будет иметь уменьшенную, а другая - увеличенную частоту. Последнее обстоятельство, как показали в 1927 г. Гейтлер и Лондон, и является основной причиной прочности ковалентной связи. [55]
Страницы: 1 2 3 4