Псевдоуридин
Cтраница 1
Псевдоуридин дает с орцином характерную для нейраминовой кислоты реакцию, в то время как дигидронуклеозид, сохраняющий поглощение в ультрафиолетовой области, не дает этой реакции. Поэтому дигидропсевдоуридин представляет собой 5-рибитилурацил и восстановление является, скорее всего, гидрогенолизом, а не насыщением 4 5-двойной связи ( ср. [1]
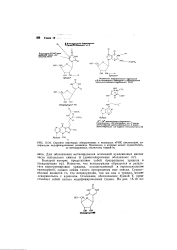 |
Строение некоторых обнаруженных в молекулах тРНК нуклеозидов, содержащих модифицированные основания. Положения, в которых может осуществляться метилирование, обозначены буквой т. [2] |
Известно, что псевдоуридин образуется в результате перегруппировки уридина, осуществляемой в первоначальном гранскрипте, однако химия такого превращения еще неясна. Существенным является то, что псевдоуридин, так же как и урацил, может спариваться с аденином. Основание, обозначаемое буквой Y, представляет со бой сильно модифицированный гуанин. [3]
 |
Константы скорости псевдопервого порядка реакции. [4] |
Скорость модификации остатков псевдоуридина в тРНК зависит от вторичной структуры полимера. При взаимодействии акрилонитрила с суммарной тРНК из дрожжей в диметилсульфоксиде, содержащем 10 - 50 % воды, степень модификации псевдоуридина в стандартных условиях увеличивается по мере увеличения содержания воды296, что связано с изменением вторичной структуры. Параллельно происходит уменьшение акцепторной активности тРНК из дрожжей. [5]
Отличие химического поведения псевдоуридина от поведения обычных пиримидиновых нуклеозидов связано с двумя особенностями его структуры: наличием двух атомов азота, связанных с водородом, и присутствием С-гликозидной связи. [6]
Поскольку в молекуле псевдоуридина остаток рибозы присоединен к атому С-5 пиримидинового кольца, фотохимическое поведение псевдоуридина резко отлично от поведения других производных уридина. Характер фотолиза псевдоуридиловых кислот зависит от положения фосфатной группы. При облучении псевдоуридин-3 - фосфата в продуктах реакции обнаружен неорганический фосфат, 5-формилурацил и неидентифицированное соединение, не содержащее фосфора, но сохраняющее, вероятно, пиримидиновое ядро. [7]
 |
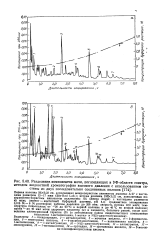
Окисление псевдоуридин - З - фосфата и уридин-2 ( З - фосфата периодатом при 50 С. [8] |
Данные по периодатному окислению псевдоуридин - З - фосфата и уридин-2 ( 3) - фосфата приведены в табл. 11.1. При рН 7 5 урацил-5 - карбоновая кислота является единственным продуктом окисления псевдоуридин - З - фосфата, поглощающим в ультрафиолетовой области; одновременно становится заметным и другой процесс - разрушение соединения с потерей характерного поглощения в УФ-области спектра. [9]
 |
Разделение компонентов мочи, поглощающих в УФ-области спектра, методом жидкостной хроматографии высокого давления с использованием системы из двух последовательно соединенных колонок. [10] |
Выделены: / - псевдоуридин, 2 - метилксантин, 3 - мочевая кислота, 4 - 2-фуроилгли-цин, 5 - гиппуровая кислота, 6 - 4-оксибензоилглицин, 7 - ванилиновая кислота, 8 - 1-метилинозии, 9 - 1-метилгуанозин, 10 - М ( 2) - диметилгуанозин, 11 - аллопуринол, 12 - оксипуринол, 13 - 1 -метилксантин, 14 - оротидин, 15 - оротиновая кислота, 16 - 3-меток-си - 4-оксифенилуксусная кислота. [11]
При действии щелочи на псевдоуридин образуются изомерные нуклеозиды. [12]
Уже при установлении строения псевдоуридина 6 было отмечено, что это соединение довольно легко претерпевает мутаротацию - образуются изомеры, различающиеся размером цикла углеводного остатка и конфигурацией гликозидной связи. [13]
За исключением особого случая псевдоуридина ( гликозидная связь которого образована этиленовым атомом углерода), для природных нуклеозидов ( N-гликозидов) не было получено убедительных фактов о наличии мутаротации. [14]
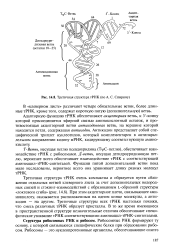 |
Третичная структура тРНК ( по А. С. Спирину. [15] |
Страницы: 1 2 3 4 5