Псевдоуридин
Cтраница 2
Ветвъ, несущая петлю псевдоуридина ( ТуС - петлю), обеспечивает взаимодействие тРНК с рибосомами. [16]
Наиболее хорошо известный С-нуклеозид, псевдоуридин, был синтезирован прямой реакцией конденсации. Однако в целом для синтеза С-нуклеозидов методы конденсации используются редко, поскольку требуются более предсказуемые и гибкие методы. [17]
Различие в реакционной способности остатков псевдоуридина в тРНК по отношению к действию акрилонитрила было показано и при модификации индивидуальной аланиновой тРНК из дрожжей298, содержащей 1 остаток инозина и 2 остатка псевдоуридина. [18]
То, что гликозидный центр природного псевдоуридина имеет p - D-конфигурацию, было доказано получением толуолсульфопроиз-водных 2 3 -изопропилиденпсевдоуридина. [19]
Легче всего взаимодействуют с акрилонитрилом редкие компоненты тРНК - псевдоуридин 292 - 295) Инозин 294295 и 4-тиоуридин 295; реакция гладко протекает уже в слабощелочной среде. Из псевдо-уридина образуется 1-цианэтилпсевдоуридин XCVIII, который в дальнейшем медленно превращается в 1 3-дицианэтильное производное XCIX. Продуктом реакции с инозином является 1-цианэтил-инозин С; в случае же 4-тиоуридина цианэтилирование протекает по атому серы ( см. стр. [20]
Образование первых трех продуктов реакции может быть объяснено переходом псевдоуридин - З - фосфата в щелочной среде в соединение XVII и его последующей гидратацией. [21]
С наибольшей скоростью модифицируются редкие компоненты нуклеиновых кислот - инозин и псевдоуридин. Реакция с карбодиимидом практически не идет с двухцепочечными полинуклеоти-дами. [22]
К нуклеозидам с различными основаниями, перечисленным здесь, мы можем добавить псевдоуридин, который отличается от ури-дина тем, что содержит урац ил, присоединенный к атому С-5 ри-бозы. [23]
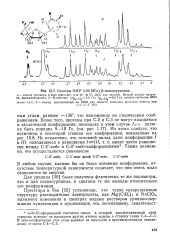 |
Спектры ПМР ( 100 МГц р-псевдоуридина. [24] |
Для уридина [50] были получены фактически те же параметры, что и для псевдоуридина, и сделаны те же выводы относительно его конформации. [25]
Аналогичная смесь образуется при изомеризации в тех же условиях всевдоури-дина В; изомеризация пиранозных изомеров псевдоуридина идет заметно медленнее, и равновесие за 1 ч не достигается. [26]
Поскольку в молекуле псевдоуридина остаток рибозы присоединен к атому С-5 пиримидинового кольца, фотохимическое поведение псевдоуридина резко отлично от поведения других производных уридина. Характер фотолиза псевдоуридиловых кислот зависит от положения фосфатной группы. При облучении псевдоуридин-3 - фосфата в продуктах реакции обнаружен неорганический фосфат, 5-формилурацил и неидентифицированное соединение, не содержащее фосфора, но сохраняющее, вероятно, пиримидиновое ядро. [27]
Он входит в состав псевдоуридиловой кислоты, которая существует в форме 2 -, 3 - и 5 -фосфата псевдоуридина. [28]
Реакциями такого типа, по-видимому, являются некоторые реакции алкилирования, например взаимодействие гуанозина, уридина, инозина и псевдоуридина с акрилонитрилом ( подробнее см. гл. [29]
Помимо этих компонентов с N-гликозидной связью в состав тРНК входит в довольно значительных количествах необычный ну-клеозид с С-гликозидной связью - так называемый псевдоуридин - 5 - ( р - /) - рибофуранозил) - урацил XXV230; он найден также в составе рибосомальной РНК. [30]
Страницы: 1 2 3 4 5