Атомный радиус - металл
Cтраница 1
Атомный радиус металла значительно больше его ионного радиуса в каком-либо соединении. Например, радиус иона натрия в кристаллах поваренной соли равен 0 98 А, а его атомный радиус в кристалле металлического натрия - 1 89 А. [1]
Атомные радиусы металлов II группы значительно меньше атомных радиусов соседних металлов I группы вследствие увеличения заряда ядра атомов; число связывающих электронов в два раза больше, поэтому металлы II группы имеют более высокие точки плавления, кипения и большие плотности. [2]
ЙМА - сумма атомного радиуса металла и ковалентного радиуса адсорбированного атома, за исключением случаев атомов щелочного металла, когда вместо duA подставляется радиус одновалентного иона. [3]
Аналогично ситуации с атомными радиусами металлов можно полагать, что это - влияние происходящего заполнения d - орбиталей наполовину и более ( разд. [4]
Радиусы металлических связей ( атомные радиусы металлов) представлены в табл. 3.6. На основании приведенных величин можно сделать ряд выводов. [5]
В табл. 71 приведены атомные радиусы металлов. Для металлов, кристаллизующихся в структурах с координационным числом 12 ( плотные упаковки), за радиус в таблице взята половина межатомного расстояния, найденного рентгеноструктурным методом. В случае металлов, кристаллизующихся в решетке с координационным числом, не равным 12, значения атомных радиусов несколько исправлены с целью получения сравнимых величин, поскольку известно, что атомный радиус изменяется в зависимости от координационного числа решетки, в которой содержится данный атом ( стр. [6]
С уменьшением разницы между размерами атомных радиусов металлов компонентов взаимная растворимость сульфидов увеличивается. Структурный тип, в котором кристаллизуется данный сульфид, и химический тип строения не играют существенной роли при образовании твердых растворов с ограниченной взаимной растворимостью. [7]
С уменьшением разницы между размерами атомных радиусов металлов компонентов взаимная растворимость сульфидов увеличивается. Структурный тип, в котором кристаллизуется данный сульфид, и химический тип строения не играют существенной роли при образовании твердых растворов с ограниченной взаимной растворимостью. [8]
В пределах одного периода в направлении слева направо атомные радиусы металлов уменьшаются. В той же последовательности возрастает электрический заряд атомного ядра, причем происходит увеличение числа электронов, находящихся на одной оболочке. Поскольку возрастает число связывающих электронов, приходящихся на один атом, то металлическая связь упрочняется, и вместе с тем из-за увеличения числа электронов возрастают эффекты экранирования, в связи с чем кажущаяся величина атома уменьшается. [9]
Фазы внедрения могут образовываться при определенных соотношениях атомных радиусов металлов и неметаллов. [10]
На рис. 2 изображены зависимости перенапряжений водорода от атомного радиуса металла электрода. Верхняя кривая - та же зависимость, но проведенная через одну опытную точку для ртути. [11]
Естественно ожидать, что разница перенапряжений водорода и дейтерия должна являться функцией атомных радиусов металла. В соответствии с этим отношение скоростей электролитического выделения водорода и дейтерия, определяющее величину коэффициента разделения, должно быть функцией атомного радиуса. [12]
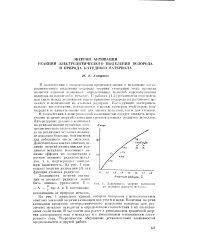 |
Зависимость. шергии активации от атомного радиуса металла. [13] |
В соответствии с вышеуказанной зависимостью следует ожидать возрастания величин энергий активации с ростом атомных радиусов металлов. Литературные данные о величинах энергии активации процессов электролитического выделения водорода на различных металлах являются довольно бедными. Они имеются для небольшого числа металлов. На рис. 1 приведены энергии активации [3] как функции атомных радиусов. [14]
Уравнение ( 8) правильно передает зависимость энергии активации процессов электролитического выделения водорода от атомного радиуса металла. На рис. 3 приведены зависимости энергии активации от г. Кривая построена с использованием опытного значения энергии активации для ртути. [15]
Страницы: 1 2 3 4