Ковалентный радиус - атом
Cтраница 2
Значения ковалентных радиусов атомов меди и никеля обсуждаются ниже. [16]
Благодаря малому ковалентному радиусу атома фтора полная замена атомов водорода на фтор в молекуле парафинового углеводорода ( в отличие от замены их на хлор или бром) не приводит к растягиванию и ослаблению углерод-углеродных связей вследствие появления пространственных затруднений. Наоборот, эти связи как бы прикрываются, экранируются со всех сторон атомами фтора, делаясь недоступными для атак различных реагентов. [17]
Так, ковалентный радиус атома углерода С при одинарной связи равен 0 077 нм, при двойной - 0 067 и при тройной - 0 060 нм. [18]
С учетом новых ковалентных радиусов атомов углерода, укорочение связей С - С, обязанное присутствию я-связей, будет равно в этилене и ацетилене 0 079 и 0 133 А соответственно. Кривая порядок связи - длина связи, если последняя берется с поправкой на гибридизацию образующих ее атомов углерода, должна теперь лучше отражать зависимость между этими двумя величинами. [19]
Гс в - ковалентный радиус атома sp - углерода, а ях и я2 - постоянные, отвечающие первой и второй я-связям. Особенно нового Уилмшерст здесь, однако, ничего не прибавляет. [20]
А и Rв - ковалентные радиусы атомов, полученные делением простых связей А-А и В-В пополам. [21]
Оказалось также, что ковалентные радиусы атомов одного и того же периода Менделеевской системы уменьшаются по мере увеличения атомных номеров. Это связывается с соответствующим увеличением эффективного заряда ядра. [22]
Эти данные позволяют оценить ковалентный радиус атома вольфрама. А [10], находим для радиуса атома вольфрама 1 58 А. [23]
Эта величина совпадает со средним ковалентным радиусом атома углерода в ароматических системах. [24]
Возвращаясь к понятию о ковалентном радиусе атома, подчеркнем, что приведенные выше значения нормальных ковалентных радиусов, хотя и определяются экспериментально, фактически носят условный характер, поскольку форма атома в ковалентной связи далека от сферической. [25]
Как видно из табл. 4, ковалентные радиусы атомов уменьшаются по мере увеличения атомного номера в каждом периоде ( что является следствием увеличения заряда ядра) и увеличиваются по мере увеличения атомного номера внутри одной и той же группы; последнее, в основном, является следствием возрастания числа электронных оболочек. [26]
В этой и последующих таблицах приводятся ковалентные радиусы атомов элементов. [27]
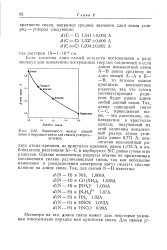 |
Зависимость между длиной. [28] |
Да равен 0 771 А; аналогично ковалентный радиус атома кремния, из кристалла кремния, равен 1 175 А, и наблюдаемое расстояние Si-С в карборунде SiC равно сумме этих радиусов. Однако ковалентные радиусы обычно не применимы к соединениям сильно различающихся типов, так как небольшие изменения в распределении электронов могут оказать сильное влияние на длину связи. [29]
Слей-тером, и г принимают равным ковалентному радиусу атома, который для гомоядернои двухатомной молекулы составляет половину межъядерного расстояния. Чтобы вычисленные силы, которые являются абсолютными электроотрицательностями, отнести к произвольно выбранным и относительным значениям по Полингу, строят график, по осям которого откладывают эти силы и значения электроотрицательности по Полингу. [30]
Страницы: 1 2 3 4