Разрыв - пептидная связь
Cтраница 2
Гидролиз происходит при действии на белок щелочей, кислот, а также протеолитических ферментов ( протеаз), катализирующих разрыв пептидных связей. Получаемый гидролизат-раствор смеси аминокислот - анализируется методами хроматографии и электрофореза. Укажем, что протеолитический гидролиз происходит при пищеварении - белки пищи расщепляются в пищеварительном тракте на аминокислоты, из которых строятся заново белки, необходимые организму. [16]
Наконец, обработка ультразвуком растворов белков и ферментов в присутствии различных газов ( активных или инертных) приводит к разрыву пептидных связей и, следовательно, к разрыву макромолекулы белка. [17]
 |
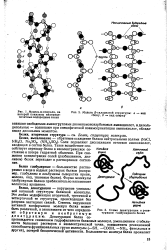
Пептидная связь. [18] |
Гидролитическое расщепление происходит при действии на белок кислот, щелочей, а также протеолитических ферментов ( протеаз), катализирующих разрыв пептидной связи. Получаемый гидролизат представляет собой смесь аминокислот. Количественное определение состава гидролизата осуществляется путем его разделения на чистые аминокислотные фракции. Для этой цели пользуются хроматографией. [19]
Среди существующих точек зрения есть теория, по которой образование пептидных связей в живых клетках осуществляется теми же ферментами, которые вызывают разрыв пептидных связей после смерти. Однако этот процесс происходит только при некоторых определенных условиях. Наиболее важным из них является противодействие естественной склонности протеолитических ферментов гидролизовать пептидные связи. Добиться того, чтобы гидролиз шел в обратную сторону, можно простым приемом - нужно выбрать такую реакцию, при которой образуется нерастворимый пептид, выпадающий из раствора по мере своего образования. Используя это обстоятельство, можно показать, что протеолитические ферменты несомненно могут катализировать образование пептидных связей. [20]
Моррисон, 1968): б) окислительное бромирование с помощью N-бромсукциннмида; вначале образуется дибромпро-изводное, а дальнейшее окисление приводит к разрыву пептидной связи и образованию дибромдиенон-спиролактона; в) реакция с цианурфторидом, позволяющая спектрофотометр и чески определять количество доступных остатков тирозина; г) ацетнлирование N-ацетил и мидазолом; д) нитрование с помощью тетранитрометана. [21]
В качестве блокирующих заместителей [ Z в схеме ( 321) ] можно использовать только такие, которые после завершения пептидного синтеза могут быть отщеплены без разрыва пептидной связи и без рацемизации. Для этого непригодны, например, ацетильная или бензоильная группы. [22]
Как упоминалось ранее, при гидролизе сильными кислотами вначале обычно происходит разрыв пептидных связей, соседних с оксиаминокислотами, в несколько меньшей степени - связей, соседних с аспарагиновой кислотой, и совсем в незначительной степени происходит разрыв пептидных связей, соседних с глут-аминовой кислотой. Дальнейший кислотный гидролиз, скорость которого зависит от природы аминокислотных остатков, протекает неизбирательно и приводит к накоплению дипептидов. Большая специфичность проявляется при низких температурах и малом времени гидролиза, так как в этих условиях сказываются различия в энергии активации для различных молекул, тогда как при более высоких температурах происходит более беспорядочный разрыв пептидных связей. При гидролизе разбавленной кислотой имеет место большая специфичность, хотя в этом случае возможно побочное образование ангидридов. [23]
Так как для направленного синтеза необходимо, чтобы вводимая аминокислота прореагировала только с другой заданной аминокислотой или пептидом, то она должна быть монофункциональна и соответственно одна из групп - амино - или карбоксильная группа - должна быть защищена определенной группировкой, которая перед проведением следующей ступени синтеза может быть достаточно легко снята без разрыва пептидной связи. [24]
Так как для направленного синтеза необходимо, чтобы вводимая аминокислота прореагиро-вала только с другой заданной аминокислотой или пептидом, то она должна быть монофункциональна и соответственно одна из групп - амино - или карбоксильная группа - должна быть защищена определенной группировкой, которая перед проведением следующей ступени синтеза может быть достаточно легко снята без разрыва пептидной связи. [25]
Каждый этап ферментативного гидролиза белков в организме происходит под действием особого фермента. Так, разрыв пептидной связи происходит под влиянием пептидаз. [26]
Если избегать кислых условий, арилирование ЫН2 - группы глицилглутамилала-нина 2 4-динитрофторбензолом дает удовлетворительные результаты. В кислых условиях легко происходит разрыв глутамильных пептидных связей. [27]
В качестве агентов, ацилирующих гидразин, могут выступать амиды, но для проведения реакции требуется более высокая температура и более длительное время, чем в случае сложных эфиров или хлорангидридов кислот [418], и выходы продуктов невелики. Эта реакция обычно используется для деградации белков путем разрыва пептидной связи. Для ацилирования гидразинов возможно использование карбоновых кислот. [28]
В знаменитой триаде аспартат-гистидин-серии протон ОН-группы серина в активном центре фермента оттянут. Это облегчает нуклеофильную атаку карбонильной группы на гидроксигруппу серина с разрывом пептидной связи, образуемой этой карбонильной группой в субстрате. Следует отметить, что при этом амидная группа разрываемой пептидной связи должна превратиться в аминогруппу, что может быть облегчено подачей протона от какой-либо кислотной группы фермента, т.е. нуклеофильный катализ может сопровождаться кислотным катализом. Ферменты могут осуществлять также электрофильный и окислительно-восстановительный катализ. В этом случае, однако, необходимо привлечение специальных кофакторов. В случае электрофильного катализа таковым может быть ион металла. Классическим примером является фермент карбоксипептида-за, который катализирует гидролиз С-концевой пептидной связи. Центральную роль играет атом Zn2, который координирован двумя имидазольными кольцами гистидинов и карбоксильной группой глутамата, сохраняя при этом один положительный заряд. Окислительно-восстановительный катализ осуществляется ферментами, использующими в качестве кофактора сложные органические молекулы, способные переносить электроны, например флавиновые нуклеотиды. [29]
 |
Модель а-спирали, на.| Модель р-складчатой структуры. а - вид сбоку, б ч вид сверху.| Схема денатурации и рена-турации глобулярного белка. [30] |
Страницы: 1 2 3 4