Распад - аммиак
Cтраница 2
Боденштейн и Кранендик221 уже давно измерили скорость распада аммиака на кварце между 780 и 880 С. Они нашли, что скорость реакции приблизительно пропорциональна парциальному давлению аммиака, но лучше изображается более сложным уравнением. Она слегка тормозится продуктами реакции, но не испыты - вает торможения от свежедобавленных азота и водорода. [16]
Существует одно затруднение, связанное с изучением распада аммиака на железе статическим методом, применявшимся этими авторами, и которое делает неопределенными их выводы относительно кинетики этого распада. В этих температурных пределах аммиак реагирует с железом с образованием нитридов, которые могут оставаться устойчивыми значительное время. Таким образом часть опыта ведется над железным катализатором, а часть над нитридом железа: более того, в некоторой части опыта реакция идет главным образом с образованием нитрида, благодаря чему происходит увеличение давления лишь на 50 % против 100 % увеличения давления, соответствующего полному распаду аммиака на азот и водород. [17]
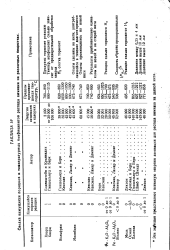 |
Сводки кажущихся порядков и температурных Коэфициентов распада аммиака на различных веществах. [18] |
Эти значения представляют истинную энергию активации для распада аммиака на данной нити. [19]
Гиншельвуд и Берк сообщают, что температурный коэфициент распада аммиака на платине соответствует энергии активации приблизительно в 140000 кал. Шваб и Шмидт нашли, что при давлениях от 0 25 до 4 мм температурный коэфициент равен около 44 000 кал; однако при давлениях свыше 10 мм МН3 кажущаяся энергия активации становилась равной около 143 000 кал. Наконец Диксон 2Э2, пользуясь динамическим методом, пришел к заключению, что в области высокого давления ( выше 100 мм PNH температурный коэфициент реакции соответствует 46 000 кал. Причина столь большой энергии активации, почти в 140000-кал, еще не выяснена. Однако Шваб и Шмидт находят как раз в той области, где реакция сильно тормозится водородом, для Ешбл значение лишь в 44000 кал. Поэтому они утверждают, что высокое значение энергии активации в 143 000 является для области высокого давления следствием какого-то необычного и еще не выясненного механизма распада аммиака. [20]
 |
К установлению химического равновесия А В в газовой фазе. [21] |
Следовательно, П Кр и реакция идет влево с распадом аммиака. [22]
Митташ, Эмерт и Кусе 26 произвели ряд интересных опытов по распаду аммиака над Fe2N в связи с изучением скорости диссоциации этого нитрида. Они нашли, что скорость распада аммиака над Fe N повидимому равна скорости диссоциации Fe2 N при той же температуре. [23]
Гиншельвуд и Берк ( Hinshelwood и Burk) 222 также измеряли скорость распада аммиака на стенках кварцевого реакционного сосуда при температурах от 800 до 1050 С. Они подтвердили, что скорость пропорциональна первой степени давления аммиака, но вместе с тем обнаружили заметное тормозящее влияние свежедобавленного водорода. [24]
Из приведенного уравнения видно, что соединение водорода с азотом сопровождается выделением, а распад аммиака на водород и азот - поглощением теплоты. Следовательно, чем большим тепловым эффектом обладает данный процесс, тем сильнее смещается равновесие с изменением температуры. [25]
Иногда взамен чистого водорода для образования дуги применяют азотно-водородную смесь, получаемую в крекерах в результате распада аммиака. На крекере устанавливают предохранительный клапан на 2 ат и термопару. [26]
Однако недавно появившаяся работа Кенсмана, Ламара и Деминга дает не только математически строгий вывод уравнения, которое для случая распада аммиака идентично с вышеприведенным, но дает возможность также и количественной обработки данных для реакций порядка, близкого к нулевому, позволяя вычислить истинную энергию активации Q при данной температуре. Важность этого анализа делает желательным его изложение на этих страницах. [27]
Аммиак сравнительно легко отдает свой водород, который может затем гореть, соединяясь с кислородом; пламенное горение аммиака в кислороде осуществимо, правда, в известных условиях, необходимых для преодоления активационного барьера, замораживающего распад аммиака. Смесь аммиака с кислородом, взятая в известном количественном соотношении, может при приближении к огню взорваться. Если газы предварительно не смешаны, то можно заставить струю аммиака, вытекающего из отверстия, гореть спокойным пламенем в атмосфере кислорода. [28]
Кенсмана, Ламара и Деминга с молибденом кинетический порядок реакции определялся нанесением на график обратной величины скорости реакции по величине PHj / PNHj, причем последнее отношение изменялось во время опыта от величины, соответствующей 15 % - ному распаду аммиака, до соответствующей 60 % - ному распаду. Результаты показывают определенное тормозящее действие продуктов реакции, но не дают возможности отличить тормозящее действие водорода от такого же действия азота. [29]
В результате распада аммиака в больших количествах образовывался азот, составляющий основу современной атмосферы, а из метана и вулканических газов образовался диоксид углерода. [30]
Страницы: 1 2 3 4