Распад - аммиак
Cтраница 3
Митташ, Эмерт и Кусе 26 произвели ряд интересных опытов по распаду аммиака над Fe2N в связи с изучением скорости диссоциации этого нитрида. Они нашли, что скорость распада аммиака над Fe N повидимому равна скорости диссоциации Fe2 N при той же температуре. [31]
Они нашли, что водород замедляет распад аммиака на меди и на железе, в то время как примешивание азота и аргона не оказывает торможения. Недавно Диксон ( Dixon) 22Т также пришел к выводу, что распад аммиака на меди обратно пропорционален парциальному давлению присутствующего водорода и прямо пропорционален парщиальному давлению аммиака. [32]
По общепринятой теории М. И. Темкина [103], распад аммиака контролируется десорбцией N2, а синтез - его хемосорбцией с поддержанием полуравновесия Na на поверхности с МНзгаз. При такой схеме изотопный водородный эффект для синтеза должен отсутствовать, а для распада возможен изотопный эффект, вызванный различием в контактах равновесия газообразного аммиака с хемосорбированным азотом и газообразным водородом. [33]
Если это уравнение верно, то о о представляет собою единственный найденный до настоящего времени случай, когда скорость рас-лада аммиака на поверхности пропорциональна более чем первой степени его давления, и является также первым случаем, когда тормозящее действие водорода характеризуется степенью, большей единицы. Все же окончательные представления о механизме и кинетике распада аммиака на платине нуждаются еще в дополнительных экспериментальных данных. [34]
В весьма сходной форме те же явления наблюдаются и яри работе платлновых и серебряных контактов. Они не специфичны для окислительного катализа, и, в частности, сходные структуры наблюдаются при распаде аммиака на железе. Образования, получающиеся вначале, малоустойчивы. Этому менее подвержены уступы и каньоны длительно работавшей поверхности. Детальный характер этих процессов и многих других, которые мы из-за ограниченности места опускаем, можно проследить, используя метод реплик. [35]
Среди сотен известных соединений можно выделить несколько типов со сходной структурой кристаллической решетки. В каталитическом отношении до наших работ эта группа представляла почти белое пятно, если не считать данных по синтезу и распаду аммиака на отдельных нитридах и синтезу Фишера-Тропша на карбидах полученных в связи с исследованиями механизма этих двух реакций на металлах. В табл. 3 приведены некоторые из исследованных соединений с весьма условной качественной характеристикой их дегидрогенизационной каталитической активности. [36]
Азот растворяется и в а - и у-железе. Однако значительное количество азота может быть поглощено железной поверхностью лишь в тех случаях, когда он находится в атомарном состоянии и является продуктом распада аммиака, в атмосфере которого осуществляется процесс азотирования. [37]
Недавно Винтер 229 произвел опыты над распадом аммиака на железе, применяя динамический метод, который дает возможность избежать многих неопределенностей, связанных с изучением этой реакции статическим методом. Винтер показал, что такая кинетическая зависимость получается в том случав, если наиболее медленной стадией реакции является удаление с поверхности атомов аэота, образующихся при распаде аммиака на поверхности железа. Интересно отметить, что для нескольких экспериментальных кривых, даваемых Винтером для зависимости скорости распада аммиака от парциального давления водорода при данной температуре и данном парциальном давлений аммиака, часть реакции происходила на катализаторе, присутсвующем еще в виде железа, а часть - уже тогда, когда значение A NH 2 / / DH давало возможность предполагать образование Fe4N, а в некоторых случаях даже и высшего нитрида. [38]
Реакция образования аммиака экзотермична, реакция распада NH3 эндотермична. Повышение температуры, согласно принципу Ле-Шателье, будет увеличивать скорость эндотермической реакции: система как бы сопротивляется нагреванию. Поэтому равновесие сместится в сторону большего распада аммиака и уменьшения той константы равновесия, для которой парциальное давление PSTH3 стоит в числителе. [39]
Реакция образования аммиака зкзотермична, реакция распада NH3 эндотермична. Повышение температуры, согласно принципу Ле Шателье, будет увеличивать скорость эндотермической реакции: система как бы сопротивляется нагреванию. Поэтому равновесие сместится в сторону большего распада аммиака и уменьшения той константы равновесия, для которой парциальное давление рун, стоит в числителе. [40]
Они нашли, что водород замедляет распад аммиака на меди и на железе, в то время как примешивание азота и аргона не оказывает торможения. Недавно Диксон ( Dixon) 22Т также пришел к выводу, что распад аммиака на меди обратно пропорционален парциальному давлению присутствующего водорода и прямо пропорционален парщиальному давлению аммиака. [41]
Недавно Винтер 229 произвел опыты над распадом аммиака на железе, применяя динамический метод, который дает возможность избежать многих неопределенностей, связанных с изучением этой реакции статическим методом. Винтер показал, что такая кинетическая зависимость получается в том случав, если наиболее медленной стадией реакции является удаление с поверхности атомов аэота, образующихся при распаде аммиака на поверхности железа. Интересно отметить, что для нескольких экспериментальных кривых, даваемых Винтером для зависимости скорости распада аммиака от парциального давления водорода при данной температуре и данном парциальном давлений аммиака, часть реакции происходила на катализаторе, присутсвующем еще в виде железа, а часть - уже тогда, когда значение A NH 2 / / DH давало возможность предполагать образование Fe4N, а в некоторых случаях даже и высшего нитрида. [42]
Конечно, еще имеются нерешенные проблемы, связанные со свойствами и особенностями аммиачных катализаторов. Однако в этом: отношении уже имеется бесспорный прогресс. На следующих страницах дается исчерпывающая сводка всех имеющихся в литературе работ по механизму каталитического синтеза и распада аммиака. Кроме того Для лучшего понимания приводимых результатов193 относительно аммиачных катализаторов дается краткое изложение-некоторых общих концепций катализа. [43]
В случае кварца Боденштейн и Кранендик нашли невысокое и меняющееся значение температурного коэфициента, именно скорость увеличивалась лишь в 1 3 раза при повышении температуры от 780 до 880 С. Гиншельвуд и Берк получили гораздо более высокий температурный коэфи-циент, который притом не изменялся сколько-нибудь правильным образом с изменением процента распада аммиака. Однако полученные значения сильно зависели от изменений поверхности кварце-вых сосудов. [44]
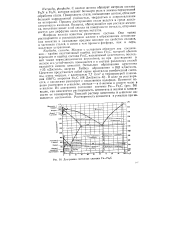 |
Диаграмма состояния системы Fe - Fe3C. [45] |
Страницы: 1 2 3 4