Распад - гидроперекись
Cтраница 2
После распада гидроперекиси молекула лавсана распадается. Могут образоваться также неустойчивые циклические окиси и перекиси, которые при разрыве образуют карбонильные и карбоксильные группы, ослабляющие эфирную связь и облегчающие ее разрыв. [16]
Механизм распада гидроперекиси в присутствии St2Gu, по-видимому, заключается в следующем. Стеарат меди образует с гидроперекисью комплекс, который распадается далее с образованием свободного радикала и одновалентной меди. Последняя медленно реагирует с гидроперекисью; поэтому изменение валентного состояния меди приводит к замедлению распада гидроперекиси. [17]
Скорость распада гидроперекиси на радикалы при повышенных температурах значительна. Другим источником свободных радикалов в реакции окисления могут служить продукты с ослабленными С - Н - связями ( альдегиды, жетоны), которые реагируют с кислородом с образованием свободных радикалов. [18]
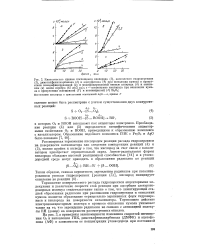
Скорость распада гидроперекисей на разных окисных катализаторах коррелирует со скоростью окисления соответствующих органических соединений. Это указывает однозначно на то, что каталитический эффект в данном случае связан с образованием дополнительных количеств свободных радикалов в процессе окисления за счет распада гидроперекисей на радикалы на поверхности катализатора с последующим переходом свободных радикалов в объем окисляющегося вещества. [19]
Процесс распада гидроперекисей в присутствии гетерогенного катализатора е всегда, однако, осуществляется по такому механизму. [20]
Скорость распада гидроперекисей значительно ниже скорости полимеризации. Надо полагать, что инициирование реакции в этом случае происходит вследствие распада перекисных соединений с образованием активных свободных радикалов. [21]
Реакции распада гидроперекисей имеют близкие значения констант скоростей, независимо от природы углеводорода. За исключением случая третич / 1л бутилгидроперекиси предэк-споненцпальные множители равны Ю12 - Ю13 сек. [22]
Механизм распада гидроперекиси в присутствии StaCu, по-видимому, заключается в следующем. Стеарат меди обравует с гидроперекисью комплекс, который распадается далее с образованием свободного радикала и одновалентной меди. Последняя медленно реагирует с гидроперекисью; поэтому изменение валентного состояния меди приводит к замедлению распада гидроперекиси. [23]
Кинетика распада гидроперекисей в растворах имеет сложный характер, зависящий от условий протекания процесса. С изменением начальной концентрации гидроперекиси изменяется порядок реакции распада. [24]
 |
ЭПР-спектр ион-радикала О Г, образующегося при адсорбции кислорода на поверхности MgO, содержащей ион Мо5. Температура 25 С.| Зависимость каталитической активности окислов металлов при жидкофаз. [25] |
Скорость распада гидроперекиси кумола на разных окислах коррелирует со скоростью окисления кумола в присутствии этих же окислов. [26]
Торможение поверхностного распада гидроперекиси акцепторными молекулами и увеличение скорости этой реакции при адсорбции электроно-донорных молекул свидетельствуют также о том, что лимитирующей стадией образования радикалов при разложении гидроперекиси и окислении кумола является образование отрицательно заряженных форм гидроперекиси и кислорода на поверхности катализатора. Тормозящее действие электроноакцепторньгх молекул в процессе окисления кумола указывает также на то, что зарождение радикалов не связано с активацией молекулы RH ( донор) на поверхности рассмотренных окислов. [28]
Продукты распада гидроперекисей цикленов ( спирты и кетоны) также сохраняют ненасыщенные связи. [29]
Направление распада гидроперекиси вторичных алкилов зависит от условий. [30]
Страницы: 1 2 3 4