Распад - гидроперекись
Cтраница 3
С распадом гидроперекисей в процессе окисления, помимо их участия в последовательном образовании конечных продуктов, связывается также характерное для окисления углеводородов явление автоускорения процесса. [31]
При распаде гидроперекиси образуются примерно равные количества тетралона-1 и тетралола-1. [33]
При распаде гидроперекиси одновременно возникают и гидр-оксильные радикалы, которые служат источником возбуждения реакции гомополимеризации мономера. Таким образом, в реакционной смеси образуются привитой полимер и гомополимер. [34]
При распаде гидроперекиси образуются два свободных радикала, которые, реагируя с молекулами парафина, дают различные продукты. [35]
 |
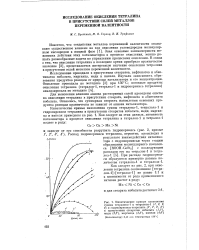
Кинетика расхода гидроперекиси при термическом разложении оксидатов. [36] |
При распаде гидроперекиси кумола в среде кумола ( рис. 3) не наблюдается никаких осложнений процесса за счет образующихся летучих продуктов распада: термический распад в ампулах и при продувке раствора азотом происходит с одной и той же скоростью. [37]
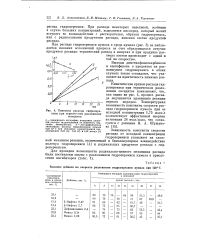
При распаде гидроперекиси ацетила образуется по одной молекуле С02 и СН4 при распаде перекиси ацетила по две молекулы. Как видно из рис. 4, это соответствует возможному выделению 12 4 цм / см3 С02 СН4, в то время как из опытных данных ( рис. 3) получается 16 jiM / см3 газа. При этом С02 и СН4 выделяются в равных количествах. Распад метилгидро-перекиси в наших условиях не дает газообразных продуктов. [38]
Если бы распад гидроперекиси на радикалы происходил по реакции ( 1), то скорость последней должна была бы быть пропорциональна корню квадратному из концентрации гидроперекиси. [39]
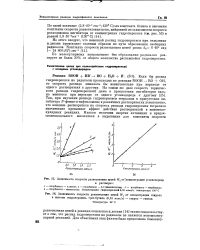 |
Зависимость скорости разветвления цепей.| Зависимость скорости разветвления цепей W от концентрации стирола в системе гидроперекись трет. бутила ( 0 16 молъ / л - стирол - гептан. [40] |
Если бы распад гидроперекиси на радикалы происходил по реакции ROOH - RO ОН, то скорость распада менялась бы незначительно при переходе от одного растворителя к другому. Так, при изучении распада гидроперекиси тетралила в присутствии ингибитора Л - фенил-а-нафтиламина в различных растворителях установлено, что влияние растворителя на скорость распада гидроперекиси тетралила значительно превышает эффект действия растворителей в мономолекулярных реакциях. [41]
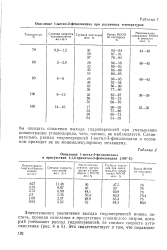 |
Окисление 1-метил - З - фенилиндана при различных температурах. [42] |
Следовательно, распад гидроперекисей 1-метил - З - фенилиндана в основном проходит не по мономолекулярному механизму. [43]
Марганец ускоряет распад гидроперекисей, окисление кетонов, альдегидов, кетокислот до кислот. В этом состоит его регулирующая функция и поэтому он должен присутствовать в активном состоянии в окси-дате на протяжении всего процесса окисления. Концентрация промежуточных продуктов в этом случае меньше, и возможность протекания процессов конденсации снижается. [44]
Образование и распад гидроперекиси циклогексила не исчерпывают всего многообразия промежуточных реакций, имеющих место при жидкофазном окислении циклогексана. Циклогексанол и циклогексанон также подвергаются ряду дальнейших превращений. [45]
Страницы: 1 2 3 4