Распад - гидроперекись
Cтраница 4
Теперь рассмотрим распад гидроперекиси в полипропилене. Образовавшиеся в результате реакции радикалы, по-видимому R - и RO -, являются макрорадикалами и окружены со всех сторон молекулами полимера. Диффузия таких радикалов сильно затруднена, и они продолжительное время находятся вблизи друг друга. Следовательно, весьма вероятно, что часть этих радикалов рекомбинирует, не оказав никакого действия на процесс окисления. Если это расстояние достаточно велико, то радикалы уже не могут рекомбинировать и в конце концов выходят из клетки. Рассмотрим, каким образом кислород может влиять на вероятность выхода радикалов из клетки. [46]
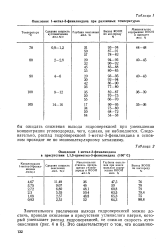 |
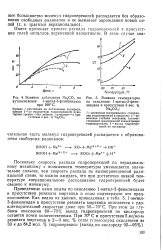
Окисление 1-метил - З - фенилиндана при различных температурах. [47] |
Следовательно, распад гидроперекисей 1-метил - З - фенилиндана в основном проходит не по мономолекулярному механизму. [48]
Если бы распад гидроперекиси на радикалы происходил по реакции ROOH - RO ОН, то скорость распада менялась бы незначительно при переходе от одного растворителя к другому. Так, при изучении распада гидроперекиси тетралила в присутствии ингибитора Л - фенил-а-нафтиламина в различных растворителях установлено, что влияние растворителя на скорость распада гидроперекиси тетралила значительно превышает эффект действия растворителей в мономолекулярных реакциях. [50]
Реакция же распада гидроперекиси, как показали опыты с химическим анализом расходования гидроперекиси, имеет первый порядок и в условиях отсутствия кислорода. [51]
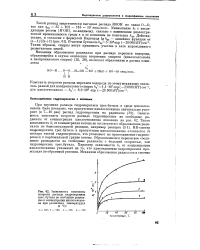 |
Зависимость константы скорости распада гидроперекиси трет, бутила на свободные радикалы от концентрации циклогексанона при различных температурах ( в С. [52] |
При изучении распада гидроперекиси трет. Образовавшееся перекисное соединение распадается на свободные радикалы с большей скоростью, чем гидроперекись трет. Характер зависимости ki от концентрации циклогексанона указывает на то, что присоединение гидроперекиси происходит по обратимой реакции. [53]
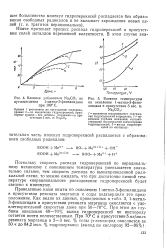 |
Влияние добавления Na2CO3 на.| Влияние температуры на окисление 1-метил - З - фенилиндана в присутствии 3 вес. % Na CO3. [54] |
Поскольку скорость распада гидроперекисей по нерадикальному механизму с понижением температуры уменьшается значительно сильнее, чем скорость распада по вышеприведенной радикальной схеме, то можно ожидать, что при достаточно низкой температуре нерациональное расходование гидроперекисей будет сведено к минимуму. [55]
Константы скорости распада гидроперекиси циклогексила в среде циклогексана, окисляющегося в стеклянном реакторе, значительно выше, чем при распаде в эвакуированных стеклянных ампулах. Это также указывает на индуцированный распад. Тем не менее эта константа примерно вчетверо ниже, чем в случае окисления в стальном реакторе. Это различие скоростей распада гидроперекиси циклогексила позволяет понять причину высокой предельной концентрации гидроперекиси при окислении циклогексана в стеклянном сосуде. [56]
Состав продуктов распада гидроперекиси циклогексила мало зависит от условий, в которых протекает эта реакция. Образование капронового альдегида является результатом изомеризации свободного циклогексилоксирадикала. [57]
При исследовании распада гидроперекиси третичного бутила под действием октоата кобальта было установлено, что комбинация эпоксисмолы Эпон 834 с кадмиевым мылом является лучшим ингибитором распада перекиси, чем каждый из компонентов в отдельности; по эффективности действия эта смесь близка к дилаурату дибутилолова. [58]
 |
Влияние добавления Na2CO3 на.| Влияние температуры на окисление 1-метил - З - фенилиндана в присутствии 3 вес. % Na2CO3. [59] |
Поскольку скорость распада гидроперекисей по нерадикальному механизму с понижением температуры уменьшается значительно сильнее, чем скорость распада по вышеприведенной радикальной схеме, то можно ожидать, что при достаточно низкой температуре нерациональное расходование гидроперекисей будет сведено к минимуму. [60]
Страницы: 1 2 3 4