Расположение - орбиталь
Cтраница 2
 |
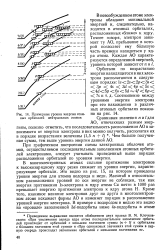
Физический смысл магнитного квантового числа.| Число орбиталей на подуровне. [16] |
Таким образом, магнитное квантовое число определяет расположение орбиталей в пространстве относительно выбранной системы координат. Общее число возможных значений те показывает, сколькими способами можно расположить орбитали данного подуровня в пространстве, т.е. общее число орбиталей на подуровне. [17]
Выбор направления оси z определит орбиталь dz, расположение остальных орбиталей тогда очевидно. Возмущение атома окружающими лигандами снимает это вырождение. Ион титана окружен симметрично шестью молекулами воды, расположенными по осям х, у и z ( рис. 27), причем наиболее близкими к центральному иону оказываются области отрицательного заряда. Тогда электростатическое поле лигандов будет отталкивать электроны центрального иона от лигандов в направлении вдоль осей. [19]
Выбор направления оси z определит ориентацию орбитали dz; расположение остальных орбиталей тогда очевидно. [20]
Возможны ли для октаэдрически координированного иона V2 различия в расположении орбиталей в случаях лигандов сильного или слабого поля. [21]
Вариации заместителей, радикалов и структуры МОС позволяют значительно изменять расположение лазерных орбиталей и влиять на частоту излучаемого света. [22]
Эти состояния получены вышеописанным способом в предположении, что порядок расположения орбиталей тот же, что и ранее на фиг. В этой таблице обозначение ( l i) 2 относится к АГ-оболочке атома X. Оно не повторяется в последней колонке. Большинство из состояний, предсказываемых согласно табл. 33, наблюдалось экспериментально. [23]
При построении Ti-системы бутадиена из двух локализованных Ti-связей ( см. рис. 2.8) расположение орбиталей относительно энергетического уровня атомной / 7-орбитали остается симметричным. То же самое будет наблюдаться, если соединить два бутадиеновых фрагмента в октатетраен или бутадиеновый фрагмент двумя концами с этиленовым фрагментом в молекулу бензола. Во всех этих случаях мы начинаем с двух симметрично расположенных наборов орбиталей, и в результате возмущения получаем также симметричное расположение МО конечного полиена. [24]
Таким образом, химические свойства элементов, которые систематизированы в периодической таблице, определяются расположением орбиталей по энергии. Орбитали многоэлектронных атомов можно непосредственно связать с орбиталями атома водорода, необходимо только учесть межэлектронное отталкивание. [25]
В более широком аспекте термин стереоэлектронные эффекты относится к тем случаям, когда течение реакции зависит от расположения орбиталей. [26]
 |
Примерные уровни энергии атомных орбиталей нейтральных атомов. [27] |
При графическом построении схемы электронных оболочек атомов, осуществляемом последовательным заполнением атомных орбита-лей электронами, следует учитывать приведенный выше порядок расположения орбиталей по уровням энергии. [28]
Числа, предшествующие символу симметрии в первом столбце табл. 7, являются не квантовыми числами, а просто порядковым номером для расположения орбиталей каждого вида симметрии в порядке возрастания орбитальной энергии ( см. VII. Наиболее очевидная особенность табл. 7, имеющая очень большое значение, в том, что шесть а-орбиталей и четыре эт-орбитали образуют совершенно определенные группы. Если бы не было этого резкого различия между а - и я-орбиталями, было бы почти невозможно разрабатывать квантовую химию алкеновых молекул. [29]
Эффект заметен в случае плоского силана SiH4, в котором пустые rf - орбитали кремния еще лежат достаточно высоко и эффективно не участвуют в связывании, но порядок расположения орбиталей ниой, чем у плоского метана. [30]
Страницы: 1 2 3 4
