Расположение - орбиталь
Cтраница 3
Мы последовательно приписываем фазы орбиталям таким образом, чтобы сделать минимальным число изменений знака ( узлов), хотя было показано, что это условие не является обязательным, и правильный вывод об устойчивости переходного состояния будет получен независимо от того, какое расположение индивидуальных атомных орбиталей нарисовано [ 5, 7J - После того как изображено расположение взаимодействующих орбиталей, необходимо установить две особенности системы, чтобы определить, будет ли соответствующее переходное состояние ароматическим или антиароматическим; этими особенностями являются топология расположения орбиталей и число участвующих электронов. Имеется два типа систем орбиталей, которые называют типом Хюккеля И типом Мебиуса. Система Хюккеля имеет нулевое ( иди четное число) изменений знака в последовательности расположения орбиталей. Для взаимопревращения циклобутек-бутадиен конрота-торная циклизация приводит к системе Мебиуса, э дисротэторная циклизация-к системе Хюккеля. Второй важной особенностью переходного состояния является число участвующих электронов; в этом случае их четыре. [31]
Мы последовательно приписываем фазы орбиталям таким образом, чтобы сделать минимальным число изменений знака ( узлов), хотя было показано, что это условие не является обязательным, и правильный вывод об устойчивости переходного состояния будет получен независимо от того, какое расположение индивидуальных атомных орбиталей нарисовано [ 5, 7J - После того как изображено расположение взаимодействующих орбиталей, необходимо установить две особенности системы, чтобы определить, будет ли соответствующее переходное состояние ароматическим или антиароматическим; этими особенностями являются топология расположения орбиталей и число участвующих электронов. Имеется два типа систем орбиталей, которые называют типом Хюккеля И типом Мебиуса. Система Хюккеля имеет нулевое ( иди четное число) изменений знака в последовательности расположения орбиталей. Для взаимопревращения циклобутек-бутадиен конрота-торная циклизация приводит к системе Мебиуса, э дисротэторная циклизация-к системе Хюккеля. Второй важной особенностью переходного состояния является число участвующих электронов; в этом случае их четыре. [32]
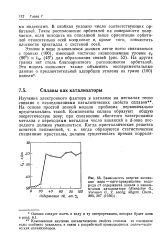 |
Зависимость энергии активации пара - opro - превращения водорода от содержания никеля в никель-медном катализаторе ( Rienacker G., Vormum G., Z. artorg. allgem. Chem., 283, 287 ( 1956. [33] |
В скобках указано число соответствующих ор-биталей. Такое расположение орбиталей на поверхности получается, если исходить из описанной выше ориентации орбита-лей относительно осей координат и, кроме того, совместить плоскости кристалла с системой осей. [34]
Такое расположение МО по энергии наблюдается для всех гомоядерных двухатомных молекул, образованных элементами второго периода, кроме 02 и F2; в этих же молекулах орбитали яи2р и og2p заполнены, и поэтому расположение их по энергии оказывается существенным лишь при рассмотрении возбужденных состояний. Однако если не рассматривать возбужденные состояния, то порядок расположения орбиталей по энергиям [ выражение (10.25) ] позволяет объяснить свойства симметрии основного состояния всех гомоядерных двухатомных молекул, образованных элементами второго периода, и их положительных ионов столь же успешно, как это удается сделать при выявлении свойств симметрии основных состояний элементов на основе расположения по энергиям АО ( гл. В табл. 10.2 приведены электронные конфигурации, соответствующие основному состоянию гомоядерных двухатомных молекул от Н2 до F2 и некоторых положительных молекулярных ионов. [35]
Атомы и ионы галогенов характеризуются также довольно высокой компактностью расположения орбиталей. [36]
 |
Энергии электронных уровней в ато-1 - ме водорода. [37] |
Для многоэлектронных атомов приходится пользоваться приближенными решениями уравнения Шредин-гера. Существует правило, сформулированное В. М. Клеч-ковским, которое отражает порядок электронных состояний ( орбиталей) по энергии. Порядок расположения орбиталей по энергиям, изображенный на рис. 10, справедлив только для легких элементов. Начиная с цинка, вследствие все более высокого положительного заряда ядер, картина осложняется, о чем несколько подробнее будет сказано далее. [38]
Для многоэлектронных атомов приходится пользоваться приближенными решениями уравнения Шредин-гера. Существует правило, сформулированное В. М. Клеч-ковским, которое отражает порядок: электронных состояний ( орбиталей) по энергии. Порядок расположения орбиталей по энергиям, изображенный на рис. 10, спра ведлив только для легких элементов. Начиная с цинка, вследствие все более высокого положительного заряда ядер, картина осложняется, о чем несколько подробнее будет сказано далее. [39]
 |
Перекрывание АО в молекуле воды. [40] |
Четыре электрона на / 7-орбиталях, располагаются так, что спины двух из них спарены ( пусть это рг), а два остальных ( рх и ру) имеют параллельные спины. Атомы водорода используют для образования химических связей свои ls - орбитали. На рис. III.9 показано расположение орбиталей, при котором можно ожидать максимального перекрывания. Не нужно забывать, что в ходе рассуждений предполагалась неизменность электронной структуры атома кислорода при переходе из изолированного в связанное состояние. [41]
 |
Перекрывание АО в молекуле воды. [42] |
Четыре электрона на р-орбиталях, располагаются так, что спины двух из них спарены ( пусть это рг), а два остальных ( рх и ру) имеют параллельные спины. Атомы водорода используют для образования химических связей свои ls - орбитали. На рис. II 1.9 показано расположение орбиталей, при котором можно ожидать максимального перекрывания. Не нужно забывать, что в ходе рассуждений предполагалась неизменность электронной структуры атома кислорода при переходе из изолированного в связанное состояние. [43]
 |
Предсказываемые ридбсргоаспис состояния линейной молекулы СН2. [44] |
Если электронные конфигурации молекул ХН2 в основном могут быть получены на базе электронных конфигураций объединенного атома, то при замещении атомов водорода на более тяжелые атомы это положение уже не сохраняется. Результирующий ( очень приближенный) порядок расположения орбиталей по энергии показан в правой части ранее приведенной на фиг. Уолша, тогда как соответствующий порядок расположения орбиталей для нелинейной молекулы XY2 показан в левой части диаграммы. В табл. 37 приведены низшая и первые возбужденные электронные конфигурации, полученные на основании диаграммы фиг. В обеих таблицах / sT - электроны не указаны, однако они считались при выписывании обозначений орбиталей. Следует заметить, что между С3 и В02 происходит обращение порядка расположения орбиталей 1яи и Зстц. Это обращение не следует с очевидностью из фиг. [45]
Страницы: 1 2 3 4