Распределение - электронная плотность
Cтраница 4
Распределение электронной плотности определяет многие физико-химические свойства молекул. В процессе возбуждения возможны переходы от линейной к плоской форме и от плоской к пространственной. Перераспределение электронной плотности при поглощении или испускании света нередко сопровождается изменением величины и направления дипольного момента молекул, а также их поляризуемости. Различные электронные состояния имеют неодинаковые кислотно-основные свойства, реакционные способности и другие химические параметры. [46]
Распределение электронной плотности по всей молекуле стабилизует N-окисную структуру и делает окись пиридина очень устойчивым соединением. [47]
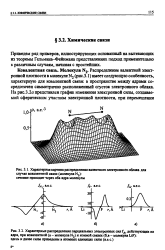
Распределение валентной электронной плотности в молекуле N2 ( рис. 3.1) имеет следующую особенность, характерную для ковалентной связи: в пространстве между ядрами сосредоточен симметрично расположенный сгусток электронного облака. [49]
Распределение электронной плотности рл - - электрона. [50]
Распределение электронной плотности атома гелия обладает сферической симметрией, рис. 8.3, а. Однако в любой данный момент времени электрон расположен в определенной точке пространства. Это очень вероятное расположение - электроны находятся довольно близко к ядру и по разные стороны от него. Склонность электронов в атомах располагаться как можно дальше друг от друга называется злектронной корреляцией; она является результатом отталкивания одноименных зарядов. [51]
Распределение электронной плотности р-орбиты промежуточного иона лиганда имеет форму гантели. Этот вывод подтверждается тем, что все двухвалентные окислы ( MnO, FeO, СоО, NiO, CuO) с кубической решеткой обладают магнитной структурой так называемого второго рода, при которой катионы, имеющие 180 -ную конфигурацию, выстроены антипараллельно друг другу. В противоположность этому, ближайшие соседи с 90 -ной взаимной ориентацией безразличны друг к другу и их спины взаимно перпендикулярны. В большом числе ферритов катионы тетраэдрических ( Т) и октаэдрических ( О) узлов имеют антипараллельные спины. Здесь связь Кт-А - Ко чаще всего является 125 -ной. [52]
 |
Схема относительных уровней энергии d - орбиталей высоко - и низкоспиновых электронных конфигураций катионов Fe ( II и Fe ( III для квадратно-плоскостной симметрии. 4 / j. [53] |
Распределение электронной плотности валентной оболочки катиона переходного металла непосредственно связано с угловой зависимостью соответствующих волновых функций, которые описывают конфигурацию d - орбиталей. В катионах переходных металлов, таких, как Fe ( II) и Fe ( III), имеется пять d - орбиталей: Ах - у - -, dzt, dxy, dxz и dyz. В отсутствие координированных лигандов орбиты пятикратно вырождены. [54]
На распределение электронной плотности в ароматическом кольце большое влияние оказывают строение и свойства находящихся в нем заместителей. В первом приближении они могут быть разделены на две группы. [55]
Страницы: 1 2 3 4