Распределение - электрон
Cтраница 2
 |
Формы электронных облаков для s -, р - и d - электронов. [16] |
Распределение электронов в атомах по энергетическим уровням и подуровням записывают при помощи электронных формул. [17]
Распределение электронов в любой системе определяется действием следующих факторов: кинетической энергией электронов, электростатическим притяжением к положительным ядрам, электростатическим отталкиванием от других электронов и принципом Паули. Влияние кинетической энергии сводится к движению электрона в некоторой части пространства, настолько большой, насколько это позволяют различные ограничения, обусловленные присутствием атомных ядер и других электронов. В настоящее время принято рассматривать электрон в виде заряженного облака, плотность которого в любой точке равна вероятности нахождения электрона в этой точке. [18]
Распределение электронов и дырок предполагается таким же, как в чистом полупроводнике. [19]
 |
Электрические свойства нитридов алюминия и скандия. [20] |
Распределение электронов у d - металлов IV группы приведено ниже. [21]
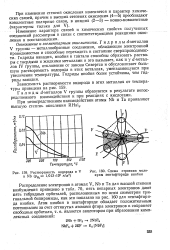 |
Растворимость водорода в V [ IMAGE ] Схема строения моле-и Nb ( Рн2 - 1 s H. MZ кулы пентафторида ниобия. [22] |
Распределение электронов в атомах V, Nb и Та для высшей степени возбуждения приведено в табл. 70, пять непарных электронов дают пять гибридных орбиталей, расположенных по осям симметрии три-гональной бипирамиды, как это показано на рис. 160 для пентафторида ниобия. [23]
Распределение электронов в атомах по энергетическим уровням и подуровням изображают в виде так называемых электронных формул. [24]
Распределение электронов в пространстве импульсов у проводящего тела может сдвинуться в направлении поля. Числа электронов, движущихся по полю и против поля, становятся разными, появляется электрический ток. У изолятора все энергетические полосы заполнены целиком. Распределение электронов сохраняет свою симметрию в пространстве импульсов, и числа электронов, движущихся влево и вправо, остаются равными друг другу - тока нет. [25]
Распределение электронов в ионах щелочных элементов и ионах галогенов показано на рис. 6.20. Не трудно заметить, что эти ионы очень схожи с соответствующими аргоноидами, показанными в несколько большем масштабе на рис. 5.8. С увеличением заряда ядра от 9е для иона фтора до Не для иона натрия соответствующие электронные оболочки сильнее притягиваются к ядру, в результате чего ион натрия оказывается примерно на 30 % меньше иона фтора. [26]
Распределение электронов в атомах элементов определяется тремя основными положениями: принципом Паули, принципом наименьшей энергии и правилом Гунда. [27]
Распределение электронов на оболочках осуществляется в соответствии с принципом Паули: в атоме не может быть двух электронов с одинаковыми значениями всех четырех квантовых чисел. Поэтому в энергетической ячейке может находиться один электрон или два электрона с противоположными спинами. [28]
Распределение электронов в атоме по энергетическим уровням и подуровням изображают в виде электронных формул. Покажем, как они составляются. [29]
Распределение электронов по энергетическим уровням ( электронным слоям) представлено в периодической системе элементов Д. И. Менделеева на первом форзаце книги. [30]
Страницы: 1 2 3 4