Распределение - электрон
Cтраница 3
 |
Схема последовательности заполнения электронных энергетических подуровней в атоме. [31] |
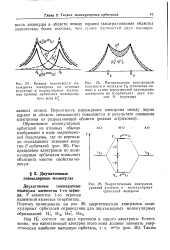
Распределение электронов по энергетическим уровням ( слоям) в атомах всех известных химических элементов приведено в периодической системе элементов, помещенной в начале книги. Последовательность заполнения электронами энергетических уровней и подуровней в атомах схематически представлена на рис. 23, графически выражающем правила Клечковского. Заполнение происходит от меньших значений суммы ( п - f - /) к большим в порядке, указанном стрелками. [32]
Распределение электронов по энергетическим уровням ( слоям) в атомах всех известных химических элементов приведено в периодической системе элементов, помещенной в начале книги. [33]
Распределение электронов по кинетическим энергиям поступательного движения описывается распределением Максвелла, а среднее расстояние между электронами велико по сравнению с длиной излучаемой волны. [34]
Распределение электронов по молекулярным орбиталям позволяет объяснить многие свойства молекул. [36]
Распределение электронов в параллельном пучке обладает аксиальной симметрией и характеризуется объемной плотностью заряда р в системе отсчета, связанной с электронами. [37]
Распределение электронов по энергии, изображенное на рис. 8 - 1, а, соответствует некоторой температуре Т, при которой в зону проводимости перешло несколько электронов, образовав в валентной зоне соответствующее число дырок. [39]
Распределение электронов по уровням энергии, изображенное на рис. 8 - 1, а, соответствует некоторой температуре Т, при которой в зону проводимости перешло несколько электронов, образовав в валентной зоне соответствующее число дырок. [41]
Распределение электронов в таком комплексе обеспечивает большую плотность электронного облака анион-радикала, а это обусловливает более длительную эмиссию электронов у поверхности металла и определяет повышенную реакционную способность такой поверхности. В зависимости от температуры и давления в зоне трущейся поверхности ( эти факторы определяют длительность существования анион-радикалов) анион-радикалы через то или иное время десор бируются с поверхности. [42]
Распределение электронов по различным квантовым состояниям подчиняется принципу Паули ( см. § 227), согласно которому в одном состоянии не может быть двух одинаковых ( с одинаковым набором четырех квантовых чисел) электронов, они должны отличаться какой-то характеристикой, например направлением спина. Следовательно, по квантовой теории, электроны в металле не могут располагаться на самом низшем энергетическом уровне даже при О К. [43]
Распределение электронов по различным квантовым состояниям подчиняется принципу Паули ( см. § 227), согласно которому в одном состоянии не может быть двух одинаковых ( с одинаковым набором четырех квантовых чисел) электронов, они должны отличаться какой-то характеристикой, например направлением спина. [44]
 |
Диаграмма уровней энергии атомных орбиталеи. [45] |
Страницы: 1 2 3 4