Среднее межмолекулярное расстояние
Cтраница 3
Это ограничение сделано для того, чтобы избежать необходимости рассматривать многократные столкновения. При развитии кинетической теории разреженных газов для применения ее к плотным газам вносятся поправки, учитывается, что в плотных газах молекулярные диаметры не малы по сравнению со средними межмолекулярными расстояниями. Перенос столкновениями является главным механизмом переноса при высоких плотностях. [31]
Эта сила, достигнув у поверхности жидкости максимума, начнет столь же резко убывать при углублении молекулы в жидкость. Объясняется это тем, что слой молекул жлдкости, оказавшийся теперь ближе к ее поверхности, будет притягивать нашу молекулу назад к поверхности жидкости и как только толщина слоя достигнет величины нескольких средних межмолекулярных расстояний, наша молекула в разной мере будет притягиваться во все стороны и на ней перестает сказываться близость поверхности жидкости. В основном, в жидкости взаимодействуют лишь соседние молекулы. [32]
Этот метод не обладает достаточной чувствительностью, вследствие чего у всех девяти исследованных этим методом парафинов начиная с пентана наблюдался только один дифракционный максимум, соответствующий значению dt 4 64 А, что согласно соотношению Ri l 23di отвечает среднему межмолекулярному расстоянию 5 7 А. [33]
Принимая, что высокая вязкость жидкости вызывается внутренним давлением, которое является результатом взаимного притяжения молекул, легко понять и причину высокого отрицательного температурного козфициента вязкости и соответствия его величине самой вязкости. Что с повышением температуры очень сильно возрастает дезагрегирующее тепловое движение жидкости, видно из сильного роста давления при нагревании жидкости при постоянном объеме ( dPldt) v, изменение другим способом внутреннего давления не должно бы быть велико в этих условиях, поскольку среднее межмолекулярное расстояние остается одним и тем же. Если нагревать жидкость без значительного увеличения внешнего давления, необходимого, чтобы поддерживать ее при постоянном объеме, ее термическое расширение, хотя сравнительно и небольшое, сильно понижает внутреннее давление, вследствие влияния межмолекулярного расстояния на притягательные силы ( стр. Это уменьшение внутреннего давления вызывает сильное понижение вязкости. [34]
Молекулы, конечно, взаимодействуют друг с другом. Иначе мы никак не смогли бы объяснить наличие жидкого и твердого состояний вещества. При средних межмолекулярных расстояниях силы взаимодействия не равны в точности нулю. [35]
В этом и многих других случаях более симметричный изомер имеет более высокие температуры плавления и кипения. Можно полагать, что это объясняется тем, что более симметричные молекулы могут в среднем теснее сближаться друг с другом. Это приводит к уменьшению среднего межмолекулярного расстояния, усилению межмолекулярного взаимодействия и вследствие этого - к росту ДЯ фазового перехода и повышению температур плавления и кипения. Влияние на температуру плавления обычно больше, чем на температуру кипения, так как высокая упорядоченность более свойственна кристаллическому состоянию, а не жидкому. Величины Д5 плавления и кипения также способствуют понижению соответствующих температур для несимметричных молекул. [37]
Как показывает приведенный выше анализ, поверхностные явления должны быть близки аналогичным величинам для соответствующих объемных фаз. Вопрос о том, как лучше сформулировать уравнение состояния растянутого монослоя, до сих пор остается открытым. Но в то же время среднее межмолекулярное расстояние в них значительно больше, чем в обычных жидкостях. [38]
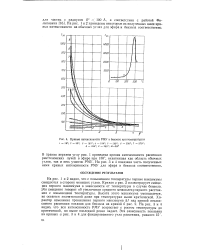 |
Кривые интенсивности РМУ в бензоле при температурах. [39] |
На рис. 1 и 2 видно, что с повышением температуры первые максимумы смещаются в сторону меньших углов. Кривая а рис. 2 иллюстрирует смещения первого максимума в зависимости от температуры в случае бензола. Это смещение говорит об увеличении среднего межмолекулярного расстояния с повышением температуры. Высота этого максимума уменьшается, но остается значительной даже при температурах выше критической. На рис. 3 и 4 видно, что вся интенсивность РМУ возрастает с ростом температуры до критической, но выше последней резко падает. [40]
Как видно из (25.5), внутренняя энергия газа Ван-дер - Ваальса, в отличие от идеального газа, зависит не только от температуры, но и от объема газа. Этот результат является следствием учета в модели Ван-дер - Ваальса сил молекулярного притяжения. Благодаря наличию сил притяжения часть внутренней энергии газа представляет собой потенциальную энергию взаимодействия молекул друг с другом, величина которой зависит от среднего межмолекулярного расстояния. При изменении объема газа меняются среднее расстояние между молекулами, энергия их взаимодействия и, следовательно, внутренняя энергия газа. [41]
Наличие кратной связи делает молекулу углеводорода компактнее. Так как частицы меньших размеров допускают более плотную упаковку в пределах радиуса корреляции, плотность жидкости возрастает ( табл. 3 и 7), уменьшается среднее межмолекулярное расстояние и, как следствие, увеличивается теплопроводность. С понижением температуры влияние ненасыщенных связей становится заметнее, поскольку увеличиваются размеры области ближней упорядоченности, в пределах которой изменение размеров частиц более существенно. [42]
В уравнениях (8.18) и (8.19) v0 - частота колебаний группы атомов, одновременно участвующих в разрыве или восстановлении связей ( для полимеров vo - 1012 с -); со и со - элементарные объемы, в которых происходит разрыв или восстановление связей при тепловых флук-туациях. Параметр со играет важную роль в термофлук-туационной теории прочности и получил название флук-туационного объема. Я - расстояние, на которое продвигается участок фронта микротрещин при каждой флуктуации ( Я по порядку величины близко к межатомному расстоянию); предполагается, что Я ЗЯ0, где АО - среднее межмолекулярное расстояние в полимере. [43]
Вязкость газов может быть рассчитана с помощью методов, основанных на теоретических предпосылках, но для определения вязкости жидкостей аналогичной теоретической базы не существует. Вязкость газа при низком давлении обусловлена главным образом передачей количества движения в результате отдельных столкновений молекул, движущихся беспорядочно между слоями с различными скоростями. Аналогичная передача количества движения может также существовать в жидкостях, хотя обычно она малозаметна из-за влияния полей сил взаимодействия между плотно упакованными молекулами. Плотности жидкостей такие, что среднее межмолекулярное расстояние не очень значительно отличается от эффективного диапазона действия таких силовых полей. [44]
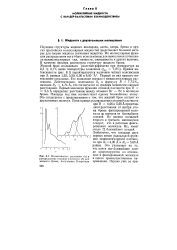 |
Интенсивность рассеяния ( а и распределение атомной плотности ( б брома, полученные. [45] |
Страницы: 1 2 3 4
