Раствор - исследуемый - вещество
Cтраница 1
Раствор исследуемого вещества доводят в мерной колбе до метки раствором электролита, который должен являться фоном при проведении титрования. В сосуд для титрования отбирают пипеткой аликвотную часть раствора и доводят фоном до нужного объема. Иногда для снижения растворимости добавляют также некоторое количество спирта или других органических веществ. Амперометрический метод позволяет определять весьма малые количества веществ - до десятых долей миллиграмма в объеме 10 - 20 мл. [1]
Раствор исследуемого вещества в метиловом спирте помещают в фарфоровую чашку диаметром около 5 см, спирт осторожно испаряют, к остатку добавляют 0 1 мл раствора хлорида аммония, содержащего следы соли Мора3 и 0 1 мл 30 % раствора перекиси водорода. Реакционную смесь перемешивают и чашку нагревают на газовой горелке. Через 5 минут по краям сухого остатка появляется розовое или красное окрашивание. Окрашивание становится интенсивнее при нанесении на остаток капли 25 % раствора гидрата окиси аммония. [2]
Раствор исследуемого вещества, приготовленный, как указано выше, охлаждают льдом до 5 - 10 С и разбавляют до объема 500 мл. Затем прибавляют из бюретки приблизительно 95 % необходимого для диазотирования количества раствора нитрита натрия и при хорошем перемешивании подкисляют 50 мл концентрированной соляной кислоты ( d 1 16), прибавляя ее быстро, в один прием. Приблизительно через 1 мин весь нитрит должен войти в реакцию. Затем титруют до конца так, как это описано выше. При этом должно израсходоваться не более 2 - 3 мл раствора нитрита. [3]
Раствор исследуемого вещества наливают в нижнюю ячейку, растворитель - в верхнюю. Щель, насыщенная паром, изолирована от внешнего воздушного пространства ртутью. [4]
Раствор исследуемого вещества, приготовленный, как указано выше, охлаждают льдом до 5 - 10 С и разбавляют до объема 500 мл. Затем прибавляют из бюретки приблизительно 95 % необходимого для диазотирования количества раствора нитрита натрия и при хорошем перемешивании подкисляют 50 мл концентрированной соляной кислоты ( d 1 16), прибавляя ее быстро, в один прием. Приблизительно через 1 мин весь нитрит должен войти в реакцию. Затем титруют до конца так, как это описано выше. При этом должно израсходоваться не более 2 - 3 мл раствора нитрита. [5]
Растворы исследуемых веществ: эргоалкалоидов - 0 1 % - ные растворы в хлороформе или ацетоне; антрахинонов - 0 5 % - ные растворы в метаноле. [6]
Раствор исследуемого вещества, так называемый внутренний раствор, с помощью мембраны отделяется при этом методе от чистого растворителя, или внешнего раствора. Происходит диффузия растворенных частиц сквозь мембрану в чистый растворитель. Путем постоянного перемешивания внутреннего и внешнего растворов стремятся, чтобы падение концентрации существовало только внутри мембраны. Объемы внутреннего и внешнего растворов относятся друг к другу примерно как 1: 100, так что изменениями концентрации, происходящими во внешнем растворе в продолжение опыта, практически можно пренебречь. Так же, как при диффузионном методе, здесь вместо чистого растворителя применяют раствор постороннего электролита, концентрация которого по меньшей мере в 10 раз превышает концентрацию исследуемого вещества. [7]
Растворы исследуемых веществ чаще всего атомизируют в пламенах, реже - в электротермических анализаторах ( см. также разделы 2.1 и 2.2), нагреваемых током в графитовых тиглях и печах; порошки - в тиглях и капсулах, помещенных в пламя. [8]
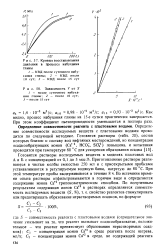 |
Кривые восстановления давления в процессе набухания глины.| Зависимость У от Л 1 - после суточного набухания глины. 2 - после 10 сут. 3 - после 15 сут. [9] |
Готовятся растворы исследуемых веществ в моделях пластовых вод А и Б с концентрацией от 0 1 до 5 мас. Приготовленные растворы разливаются в чистые колбы емкостью 250 мл и с приоткрытыми пробками устанавливаются в регулируемую водяную баню, нагретую до 80 С. По истечении времени опыта растворы отфильтровываются в горячем виде и определяется содержание ионов Са 2 трилонометрическим способом. [10]
Приготовляют раствор исследуемого вещества и замеряют угол поворота плоскости поляризации на поляриметре. Сообразуясь с полученными результатами, концентрацией раствора и рабочей длиной трубчатой кюветы, находят величину удельного вращения. [11]
Подкисляют раствор исследуемого вещества, если он щелочной или нейтральный, разбавленной соляной кислотой и прибавляют раствор хлористого бария. [12]
Каплю раствора исследуемого вещества в воде или в органическом растворителе смешивают на часовом стекле с каплей иод-азидного раствора и наблюдают за выделением пузырьков азота. [13]
Каплю раствора исследуемого вещества в эфире или в неорганической кислоте выпаривают в микропробирке досуха. После добавления 1 - 2 капель концентрированной иодистоводородной кислоты ( уд. Пробирку погружают на 5 мин. После охлаждения остаток растворяют в воде; полученный водный раствор переносят на фильтровальную бумагу, пропитанную эфирным раствором п-ди-метиламинобензальдегида. На положительную реакцию указывает появление красного пятна на индикаторной бумаге. [14]
V-объем раствора исследуемого вещества; Р0, М0 и V0 - соответствующие величины для эталонного вещества. [15]
Страницы: 1 2 3 4