Раствор - электролит
Cтраница 2
Растворы электролитов при взаимодействии с сероводородом образуют труднорастворимые аморфные или кристаллические осадки, не обладающие пространственной структурой. [16]
Раствор электролита выпускают из ванны вместе с осадком двуокиси марганца на освинцованную или гуммированную центрифугу. Здесь осадок отделяют и промывают. В связи с хорошей адсорбционной способностью двуокиси марганца отмывка ее от электролитов идет с трудом и требует большого расхода воды. [17]
Растворы электролитов обладают ионной или электролитической проводимостью, в противоположность металлам и другим проводникам первого рода, имеющим электронную электропроводность. [18]
Раствор электролита используется во всех электрохимических системах без исключения. [19]
Растворы электролитов обладают ионной или электролитической проводимостью, в противоположность металлам и другим проводникам первого рода, имеющим электронную электропроводность. [20]
Растворы электролитов относятся к средам с ионной степенью дисперсности и могут применяться в качестве самостоятельных СОТС или являться основой для приготовления многокомпонентных синтетических и полусинтетических СОЖ. Чаще всего в качестве электролитов используют соли неорганических кислот: двууглекислых натрий ( соду), хлористые калий, натрий, кальций, барий, магний; нитриты натрия, силикаты натрия; тринатрийфосфат, буру, хроматы натрия и калия и др. Соли вводятся в целях снижения ее коррозионной агрессивности и улучшения функциональных свойств. В качестве ингибитора коррозии в водных средах широко применяются нитрит натрия или двухромовокислые соли, что нежелательно ввиду их высокой токсичности. [21]
Раствор электролита засасывается в змеевик мембранным насосом. Электропроводность этого раствора определяется на первом участке измерения до змеевика. После этого другой поршень засасывает воздух и подает его в змеевик для смешивания с этим же раствором. Затем на втором участке измерения повторно производится определение электропроводности раствора. Разность электропроводности до и после введения в раствор воздуха регистрируется компенсационным самописцем. Змеевик и электроды находятся в нетермостатированной масляной бане, которая не компенсирует абсолютные колебания температуры, однако обеспечивает равенство температур на обоих участках измерения. При падении температуры воздуха ниже 0 С Ультрагаз-3 устанавливают в обогреваемую камеру. [22]
Раствор электролита, в котором процесс дегидратации менее ее трудней, обладает достаточным давлением паров над раствором, и сорбция компонентов раствора определяется их сродством к по - лимеру. [23]
Раствор электролита заползает между стенками стеклянного капилляра и столбиком ртути, плохо смачивающей стекло. Образуется сильно экранированная граница электрод-электролит, дающая вклад в результаты измерений. Эффект затекания проявляется при низких частотах и выражается в аномальном увеличении измеренных емкости Cs и сопротивления Л8 при уменьшении частоты. Эффект затекания возможен и при работе с твердыми электродами, например, из-за низкого качества спая металла со стеклом. [24]
 |
Аппаратурно-технологичес-кая схема получения водорода электролизом воды.| Схема ячейки электролизера. [25] |
Раствор электролита из коробки 7 забирается центробежным насосом 8, прогоняется через ситчатый трехслойный фильтр 9 и далее направляется через нижний питающий канал и в ячейки электролизера. [26]
Растворы электролитов даже в простейших случаях представляют собой системы. Последние возникают в результате химических реакций, происходящих с участием растворителя и растворенных веществ. Другими словами, электролиты должны рассматриваться как системы с химическими реакциями. Это обстоятельство создает предпосылки для упрощения описания таких растворов, поскольку концентрации частиц разных видов теперь перестают быть независимыми величинами. Связи между ними обусловлены типом и числом химических реакций, происходящих в системе. Заметим, что химические реакции, приводящие к возникновению ионов, как правило, завершаются ( доходят до конца в случае сильных электролитов или до положения равновесия в случае слабых электролитов) за короткий интервал времени. Используем сделанные замечания для описания явления диффузии в системе, содержащей ионы. [27]
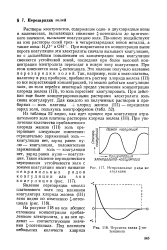 |
Неправильные ряды коагуляции. [28] |
Растворы электролитов, содержащие одно - и двухзарядныеионы в количествах, вызывающих снижение - потенциала до критического значения, вызывают коагуляцию золя. При возрастании их концентрации выше порога коагуляции эти электролиты сначала вызывают коагуляцию, но с дальнейшим повышением их концентрации зона коагуляции сменяется устойчивой зоной, последняя при более высокой концентрации электролита переходит в новую зону коагуляции. При этом изменяется знак - потенциала. [29]
Раствор электролита мы представляем в виде ионов, расположенных среди молекул растворителя. Гидратация иона сопровождается освобождением определенного количества энергии, в случае дегидратации требуется затрата такого же количества энергии. [30]
Страницы: 1 2 3 4