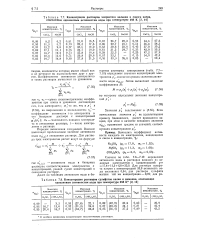
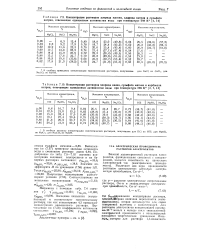
Гипотетический раствор
Cтраница 1
Гипотетический раствор, для которого АЯСМ 0, а величина AGCM определяется идеальной энтропией смешения, называют идеальным. [1]
В скобках приведены концентрации гипотетических растворов. [3]
Коэффициент активности в этом гипотетическом растворе равен единице при всех температурах, как и в бесконечно разбавленном растворе. Энтальпии стандартного и бесконечно разбавленного растворов совпадают. Стандартным состоянием растворителя в таком растворе остается его состояние как чистого вещества. Несимметричная система стандартных состояний применяется, как правило, при исследовании растворов электролитов. [4]
В качестве стандартного состояния принимается гипотетический раствор с концентрацией, равной единице, обладающий свойствами бесконечно разбавленного. При этом предполагается, что коэффициенты активности в бесконечно разбавленном растворе равны единице. А это значит, что в качестве составных частей в растворе имеются только те, которые входят в уравнение реакции. К такому раствору применимы законы, выведенные для идеальных газов. Численные значения констант равновесия для идеального состояния определяются экстраполяцией экспериментальных значений, полученных в реальных системах, на нулевые значения ионной силы. [5]
Последнее находится экстраполяцией и соответствует гипотетическому раствору, так как концентрация 4 3 превышает концентрацию насыщенного раствора. [7]
В качестве стандартного состояния растворенного вещества выбирают гипотетический раствор единичной концентрации ( измеренной в определенной шкале концентраций) при данных температуре и давлении, ведущий себя как идеальный. [8]
В качестве стандартного состояния для электролита выбирают состояние гипотетического раствора единичной концентрации в определенной шкале при температуре и давлении, равных температуре и давлению исходного раствора. [9]
Таким образом, в процессе переноса моля CaClj из гипотетического раствора со средней ионной моляльностью, равной 1, в гипотетический раствор, в котором моляльность каждого из ионов равна 1, изменения изобарного потенциала не происходит. Вполне понятно, что такие рассуждения остаются справедливыми лишь для гипотетических растворов и теряют смысл для реальных. [10]
Обычно при рассмотрении экстракционного равновесия в качестве стандартного состояния выбирают гипотетический раствор с концентрацией растворенного компонента, равной единице, при температуре и давлении исходного раствора, обладающий свойствами предельно разбавленного раствора. [11]
 |
Определение числа. [12] |
Как и ранее, один из реальных растворов можно заменить гипотетическим раствором, оптическая плотность которого равна средней оптической плотности всех растворов серии. [13]
Другая возможность заключается в: том, что расчеты производятся для гипотетического раствора, для которого все коэффициенты активности равны единице. [14]
Стандартный коэффициент Сеченова - это коэффициент солевого эффекта для газа, растворенного в стандартном гипотетическом растворе электролита единичной концентрации. [15]
Страницы: 1 2 3 4