Гипотетический раствор
Cтраница 3
Для растворенного вещества удобно выбрать другое ( второе) стандартное состояние. В качестве второго стандартного состояния выбирают гипотетический раствор с концентрацией, равной единице, но со свойствами предельно разбавленного раствора. [31]
Согласно Льюису, стандартное состояние для растворенного вещества выбирают так, чтобы в бесконечно разбавленном растворе отношение активности растворенного вещества к его концентрации стремилось к единице. При этом условии в качестве стандартного рассматривают гипотетический раствор, в котором концентрация и активность растворенного вещества равны единице, а значения таких его термодинамических характеристик, как парциальный мольный объем, теплоемкость и парциальная мольная энтальпия, равны соответствующим значениям в бесконечно разбавленном растворе. В качестве же стандартного состояния для растворителя выбирают его состояние в виде чистого вещества. [32]
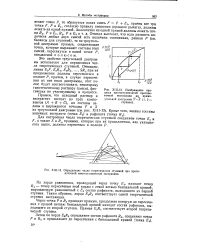
Разность этих двух потоков образует тот же гипотетический раствор S, поэтому искомый полюс диаграммы ( точка 5) лежит на пересечении прямых МЭг и Р С. [33]
Если стандартные состояния различны, активности при равновесии будут пропорциональны. Так, для электролита удобнее за стандартное состояние принимать гипотетический раствор со свойствами бесконечно разбавленного - раствора. [34]
Таким образом, в процессе переноса моля CaClj из гипотетического раствора со средней ионной моляльностью, равной 1, в гипотетический раствор, в котором моляльность каждого из ионов равна 1, изменения изобарного потенциала не происходит. Вполне понятно, что такие рассуждения остаются справедливыми лишь для гипотетических растворов и теряют смысл для реальных. [35]
В случае неводного или смешанного растворителя стандартное состояние по Льюису может быть выбрано для иона Х - независимо от стандартного состояния, установленного в водных растворах. Тогда стандартным состоянием иона Х - будет его состояние в гипотетическом растворе электролита MX в данном растворителе с единичной концентрацией и единичной активностью иона Х -, причем значения некоторых термодинамических характеристик этого раствора должны совпадать с аналогичными значениями в бесконечно разбавленном растворе ( см. разд. [36]
Вещества расположены в алфавитном пэрядке. Значения AG и Sj98 для растворенных веществ ( р) отвечают гипотетическому раствору, в котором концентрация растворенного вещества равна 1 М, но его состояние такое же, как при бесконечном разбавлении. Приводимые в этом случае значения S являются парциальными мольными величинами; они часто бывают отрицательными. Помимо состояния ( р), отвечающего бесконечному разбавлению, приводятся и гипотетические состояния бесконечно-разбавленного раствора с недиссоциированными частицами; они отмечены звездочкой. Поскольку электролиты при бесконечном разбавлении полностью диссоциируют на ионы, термодинамические параметры растворенных электролитов находят суммированием соответствующих величин для составляющих их ионов. Следует подчеркнуть, что точность приведенных величин во многих случаях является иллюзорной. [37]
Величины SA, SB и Sc являются координатами точки, общей для всех сечений экстрактора и носящей название полюса. Эта точка обычно расположена вне поля треугольной диаграммы и соответствует, следовательно, некоторому гипотетическому раствору. [38]
Это свойство треугольной диаграммы используют для определения числа теоретических ступеней. SRn при их продолжении должны пересекаться в полюсе Р, причем, в случае пересечения их вне поля диаграммы, этот полюс будет соответствовать некоторому гипотетическому раствору ( смеси), фактичски. [39]
Это свойство треугольной диаграммы используют для определения числа теоретических ступеней. SRn при их продолжении должны пересекаться в полюсе Р, причем, в случае пересечения их вне поля диаграммы, этот полюс будет соответствовать некоторому гипотетическому раствору ( смеси), фактичски не участвующему в процессе. [40]
Это свойство треугольной диаграммы используют для определения числа теоретических ступеней. SRn при их продолжении должны пересекаться в полюсе Р, причем, в случае пересечения их вне поля диаграммы, этот полюс будет соответствовать некоторому гипотетическому раствору ( смеси), фактически не участвующему в процессе. [42]
Показатель преломления ПАВ в мицеллах отличается от показателя преломления раствора, в котором они возникают. Так как размер мицелл меньше длины волны света, то при прохождении луча через раствор показатель преломления усредняется. Поэтому рефракция мицеллизованного раствора ПАВ отличается от рефракции гипотетического раствора ПАВ, который при этой же концентрации содержал бы лишь неагрегированные молекулы. Это позволяет определять ККМ по кривой концентрационной зависимости коэффициента рефракции. Однако изменение коэффициента рефракции при мицеллообразовании незначительно, так что измерять его необходимо очень точно. [43]
Показатель преломления ПАВ в мицеллярном состоянии отличается от показателя преломления раствора, в котором они возникают. Так как размер мицелл меньше длины волны света, то при прохождении луча через раствор показатель преломления усредняется. Поэтому рефракция мицел-лизованного раствора ПАВ отличается от рефракции гипотетического раствора ПАВ, в котором при той же концентрации содержались бы лишь неагрегированные молекулы. Это позволяет определять ККМ по концентрационной зависимости коэффициента рефракции. Однако изменение коэффициента рефракции при мицеллообразовании незначительно, так что измерять его надо очень тщательно. [44]
Показатель преломления ПАВ в мицеллах отличается от показателя преломления раствора, в котором они возникают. Так как размер мицелл меньше длины волны света, то при прохождении луча через раствор показатель преломления усредняется. Поэтому рефракция мицеллизованного раствора ПАВ отличается от рефракции гипотетического раствора ПАВ, который при этой же концентрации содержал бы лишь неагрегированные молекулы. Это позволяет определять ККМ по кривой концентрационной зависимости коэффициента рефракции. Однако изменение коэффициента рефракции при мицеллообразовании незначительно, так что измерять его необходимо очень точно. [45]
Страницы: 1 2 3 4