Неидеальный раствор
Cтраница 2
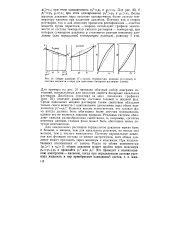 |
Общее давление ( 7 const, температуры кипения ( p const и составы жидкости и пара для идеальных бинарных растворов ( схема. [16] |
Для неидеальных растворов парциальное давление может быть и больше, и меньше, чем для идеального раствора, но всегда оно меньше, чем у чистого компонента. Поэтому парциальные давления как функции состава не имеют экстремумов, хотя общее давление может проходить через минимум и максимум. [17]
Для неидеальных растворов из уравнения Ван-дер - Ваальса вытекают правила Коновалова, свойства азеотропных смесей, правила Вревского, уравнение Клапейрона - Клаузиуса как для индивидуальных жидкостей, так и для растворов постоянного состава, уравнения для растворимости твердых тел в жидкостях. С помощью этого уравнения решаются и многие специальные задачи термодинамики растворов. [18]
Для неидеальных растворов парциальные давления и общие давления над раствором при данной температуре отличаются от этих же величин, вычисленных по закону Рауля. Отклонения могут быть положительными или отрицательными. Поскольку почти подавляющее большинство отклонений бывает положительным, наши рассуждения будут ограничены этим случаем, хотя принципы, лежащие в их основе, равно пригодны для объяснения отрицательных отклонений от закона Рауля. Чтобы оценить отклонение от закона Рауля, вводим поправочный - коэффициент f, который фактически является коэффициентом активности. [19]
Для неидеальных растворов часто между активностями и концентрациями существуют очень сложные зависимости, и в таких случаях коэфициенты активности не являются постоянными. [20]
Ддя неидеальных растворов часто между активностями м концентрациями существуют очень сложные зависимости, и в таких случаях коэффициенты активности не являются постоянными. [21]
Для неидеальных растворов АЯПЛ заменяется на АЯ - ( ftp - / iTE) [103], где / ip - парциальное молекулярное тепло-содержание растворенного вещества в растворе и Ятв - теплосодержание твердого вещества. [22]
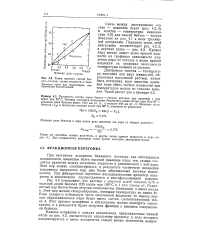 |
Точки кипения смесей бен. [23] |
Для неидеальных растворов точки нужно находить экспериментально. [24]
Для реальных неидеальных растворов удобно использовать функцию, первоначально введенную Льюисом [28], который несколько упростил уравнение ( 8 - 45) для смеси идеальных газов в применении к неидеальным растворам. [25]
Для неидеального раствора вариации отношения ks / kg должны быть, по-видимому, более значительными, нежели для идеального. Это будет тогда, когда имеется заметное притяжение между растворенными частицами или же между растворителем и одним или несколькими растворенными веществами. Подобные заметно выраженные эффекты растворителя должны проявиться в изменении энергии активации, что, вообще говоря, частично компенсируется изменением частотного фактора. Энергия испарения сильно сольватированного вещества возрастает, однако этот эффект компенсируется уменьшением эффективного свободного объема. Для иллюстрации этих соображений Бенсон приводит данные по некоторым реакциям. Экспериментальные данные относительно реакции присоединения циклопен-тадиена к бензохинону [3, 4] в различных растворителях показывают, что, хотя энергия активации и изменяется при этом на 4 ккал / моль, аррениусовский частотный фактор А также изменяется при этом в 300 раз, так что в результате скорость изменяется всего лишь примерно в пять раз. В аналогичной ( хотя и при слабее выраженных полярных эффектах) реакции димери-зации циклопентадиена в газовой фазе, а также в полярных и неполярных растворителях наблюдаются лишь небольшие изменения Е и А и весьма незначительные изменения удельной константы скорости. Более значительное влияние природы растворителя было обнаружено в случае реакции первого порядка декарбоксилирования малоновой кислоты. Цитируя работы Халла [6] и Кларка [7], Бенсон указывает, что для этой реакции, за исключением данных Халла [6] для воды в качестве растворителя при рН 9, наблюдаются вариация энтальпии активации в интервале 9 ккал и изменение удельной константы скорости примерно в 12 раз. [26]
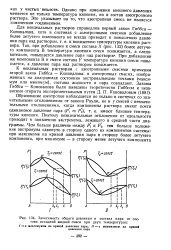 |
Зависимость общего давления и состава пара от состава исходной жидкой смеси при двух температурах. [27] |
К неидеальным растворам с азеотропными смесями применим второй закон Гиббса - Коновалова: в азеотропных смесях, изображенных на диаграммах состояния экстремальными точками ( максимум или минимум), составы жидкости и пара совпадают. [28]
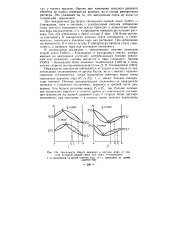 |
Зависимость общего давления и состава пара от состава исходной жидкой смеси при двух температурах. [29] |
К неидеальным растворам с азеотропными смесями применим второй закон Гиббса - Коновалова: в азеогропных смесях, изображенных на диаграммах состояния экстремальными точками ( максимум или минимум), составы жидкости и пара совпадают. [30]
Страницы: 1 2 3 4