Неидеальный раствор
Cтраница 3
К неидеальным растворам с азео фопньши смесями второй закон Коновалова: в азеотрогатых смесях, изображенных на диаграммах состояния экстремальными точками, составы жидкости и пара совпадают. [31]
В неидеальных растворах мерой взаимодействия в них молекул растворителя и растворенных частиц является активность, которую называют еще1 эффективной концентр ацией. [32]
В неидеальных растворах концентрация перестает быть вели - чиной, однозначно характеризующей раствор. Различные поправки, вводимые с целью количественного учета факторов, отличающих реальный раствор от идеального, далеко не всегда приводят к удовлетворительным результатам, а если и приводят, то лишь ценой значительных усложнений. Это создает большие практические неудобства. [33]
В неидеальных растворах мерой взаимодействия в них мо-лекул растворителя и растворенных частиц является активность, которую называют еще эффективной концентр ацией. [34]
В неидеальных растворах мерой взаимодействия в них молекул растворителя и растворенных частиц является активность, которую называют еще эффективной концентрацией. [35]
В неидеальном растворе активности отличны от концентраций. [36]
В случае неидеальных растворов закон Рауля применим к компонентам, мольная доля которых в растворе приближается к единице. [37]
Термодинамические свойства неидеального раствора принято характеризовать избыточными термодинамическими функциями, которые представляют собою разность между функциями смешения данного раствора и идеального. Избыточные функции обозначают символом АЕ. [38]
В случае неидеальных растворов химический потенциал каждого из компонентов уже не пропорционален логарифму его мольной доли. [39]
В случае неидеальных растворов попрежнему соблюдается первый закон Д. П. Коновалова, хотя при наличии азеотропов прибавление более летучего компонента не всегда увеличивает давление пара над раствором. [40]
В случае неидеального раствора плоскость acDbE превратится в криволинейную поверхность, а изобары жидкости и пара - в кривые. [41]
Рассмотрение теории неидеальных растворов на основе молекулярного взаимодействия позволяет лишь в редких случаях количественно оценить k и - у, хотя качественная трактовка иногда оказывается полезной. В специальных случаях регулярных растворов [10] при помощи уравнения Скэтчарда-Гильдсбранда можно достаточно хорошо оценить f из энергий испарения и молекулярных объемов. [42]
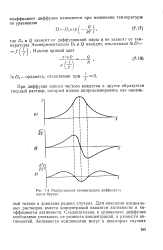 |
Распределение концентрации диффузанта вдоль бруска. [43] |
Для описания неидеальных растворов вместо концентраций вводятся активности и коэффициенты активности. Следовательно, в уравнениях диффузии необходимо учитывать не разность концентраций, а разности активностей. [44]
Термодинамические свойства неидеального раствора можно охарактеризовать избыточными термодинамическими функциями, которые представляют разность между функциями смешения данного раствора и идеального раствора. [45]
Страницы: 1 2 3 4