Разбавленный раствор - неэлектролит
Cтраница 2
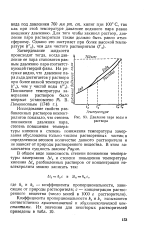 |
Давление пара воды и раствора. [16] |
Исследование свойств разбавленных растворов неэлектролитов показало, что степень понижения давления пара, степень повышения температуры кипения и степень понижения температуры замерзания обусловлены только числом растворенных частиц в определенном весовом количестве данного растворителя и не зависят от природы растворенного вещества. В этом заключается сущность законов Рауля. [17]
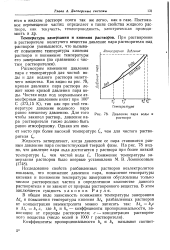 |
Давление пара воды и раствора. [18] |
Исследование свойств разбавленных растворов неэлектролитов показало, что понижение давления пара, повышение температуры кипения и понижение температуры замерзания обусловлены только числом растворенных частиц в определенном количестве данного растворителя и не зависят от природы растворенного вещества. В этом заключается сущность законов Рауля. [19]
Исследование свойств разбавленных растворов неэлектролитов показало, что величины понижения давления пара, повышения температуры кипения и понижения температуры замерзания обусловлены только числом растворенных частиц в определенном весовом количестве данного растворителя и не зависят от природы растворенного вещества. В этом заключается сущность законов Рауля. [20]
Вычисление характеристик разбавленных растворов неэлектролитов направлено на исследование закона Рауля ( относительное понижение давления пара растворителя под раствором); зависимости повышения температуры кипения ( ДТвдп) разбавленного раствора, зависимости понижения температуры замерзания ( ДТ) разбавленного раствора от моляльной концентрации m и связи осмотического давления ( тс) с молярной концентрацией С. [21]
 |
Схема прибора для измерения осмотического давления раствора. [22] |
Сходство в поведении разбавленных растворов неэлектролитов с идеальными газами голландский химик Вант-Гофф выразил в виде закона: осмотическое давление разбавленного раствора равно тому газовому давлению, которое производило бы растворенное вещество, если бы оно при той же температуре находилось в газообразном состоянии и занимало объем, равный объему раствора. [23]
Исследование равновесия фаз разбавленных растворов неэлектролитов имеет большое прикладное значение в связи с наличием эффекта разделения компонентов. Рассмотрим поэтому термодинамическое описание равновесия фаз подробнее. [24]
Ниже рассматриваются свойства разбавленных растворов неэлектролитов, зависящие от частичной ( или, соответственно, мольной) концентрации их. [25]
Из реальных растворов лишь разбавленные растворы неэлектролитов могут по своим свойствам приближаться к идеальным. [26]
Если сравнить осмотические давления разбавленных растворов неэлектролитов ( веществ, не проводящих электрический ток) одинаковой молярности, то при одних и тех же температурах они окажутся равными. Растворы, характеризующиеся одинаковым осмотическим давлением, называются изотоническими. И наоборот, если растворы двух или нескольких веществ изотонич-ны, то можно утверждать, что их молярные концентрации одинаковы. Таким образом, к осмотическому давлению растворов приложим закон Авогадро. [27]
 |
Схема осмометра. / - раствор. 2 - вода. [28] |
Закон Вант-Гоффа справедлив для разбавленных растворов неэлектролитов. Растворы с одинаковым осмотическим давлением называют изотоническими. [29]
Если сравнить осмотические давления разбавленных растворов неэлектролитов ( веществ, не проводящих электрический ток) одинаковой молярности, то при одних и тех же температурах они окажутся равными. Растворы, характеризующиеся равным осмотическим давлением, называются изотоническими. И наоборот, если растворы двух или нескольких веществ пзотоничны, то можно утверждать, что их молярные концентрации одинаковы. Таким образом, к осмотическому давлению растворов приложим закон Авогадро. [30]
Страницы: 1 2 3 4