Водный раствор - электролит
Cтраница 2
Водные растворы электролитов ( кислоты, основания, соли) широко применяются в различных технологических процессах и являются наиболее агрессивными по отношению к неметаллическим материалам. Помимо химического воздействия растворенные в воде щелочи, органические кислоты и другие соединения действуют на неметаллы как сильные поверхностно-активные вещества. [16]
Водные растворы электролитов, являясь многокомпонентными системами, обладают специфическими особенностями сорбции и переноса в неметаллических материалах. В этой связи целесообразно рассмотреть общие закономерности взаимодействия неметаллических материалов с представителями различных электролитов, объединенных в определенные группы по общим характерным признакам. [18]
 |
Графики зависимости удельной электропроводности от концентрации при 18 С. [19] |
Водные растворы электролитов представляют собой проводники второго рода, перенос тока в которых осуществляется движением ионов. Последние образуются при диссоциации веществ, находящихся в растворе. [20]
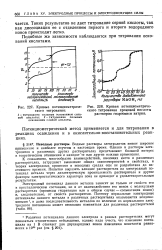 |
Кривые потенциометриче-ского титрования.| Кривая потенциометриче. [21] |
Водные растворы электролитов имеют широкое применение и наиболее изучены в настоящее время. Однако и растворы электролитов в различных других растворителях представляют большой интерес в теоретическом отношении и находят те или другие важные применения. [22]
Почему водные растворы электролитов проводят электрический ток. Чтобы понять это, недостаточно знать, что электролиты, в отличие от неэлектролитов, состоят из ионов. [23]
Почему водный раствор электролита электронейтрален. [24]
Поведение водных растворов электролитов в химических реакциях во многом зависит от того, насколько полно они распадаются на ионы. Для количественной оценки диссоциации важное значение имеют такие параметры, как степень и константа диссоциации. [25]
Для водных растворов электролитов и эмульсий принимаем у1 С 1 ккал / кг - С. [26]
Структура водных растворов электролитов с простыми ми ионами рентгенографически исследовалась Х - Майером, В. И. Даниловым и В. Е. Неймарком, И. В. Радченко, А. Ф. Скрышевским, А. [27]
Теплоемкости водных растворов электролитов при 298 15 К и бесконечном разведении, как уже отмечалось, отрицательны и, например, в ряду щелочных галогенидов изменяются от 38 Дж / ( моль - К) у LiCl до - 134 3 Дж / ( моль - К) у Csl, у галогенидов щелочноземельных и других металлов величина АнСр еще более отрицательна. [28]
Вязкость водных растворов электролитов чаще всего увеличивается с ростом концентрации электролита ( кроме разбавленных растворов аммонийных, литиевых. [29]
Для водных растворов электролитов давно установлено, что в области низких и средних концентраций теплоемкость раствора всегда ниже не только суммы теплоемкостей компонентов, но очень часто даже ниже теплоемкости, содержащейся в растворе зоды ( см. гл. [30]
Страницы: 1 2 3 4
