Водный раствор - электролит
Cтраница 4
В водном растворе электролита, например бромида калия, коэффициенты активности ионов К и Вг - зависят от всех присутствующих в растворе ионов, поскольку нельзя приготовить раствор, содержащий только катионы или анионы. [46]
В водных растворах электролитов функцию восстановителей по отношению к аноду-окислителю могут выполнить одноатомные анионы ( СГ, Вг -, Г), кислородсодержащие анионы ( NOjjy SO -, POf - и др.), а также гидрок-сильные ионы воды. Ионы ОН - занимают промежуточное положение между ними и многоатомными анионами. [47]
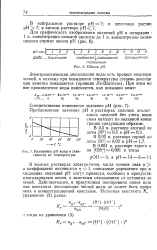 |
Изменение рН воды в зависимости от температуры. [48] |
В водных растворах электролитов, когда ионная сила ] а коэффициент активности f ф 1, описанные упрощения при в1 числениях значений рН могут привести, особенно в присутств. Действительно, в присутствии посторонних ионов исти ная константа диссоциации чистой воды не может быть прира пена к концентрационной константе. [49]
В водных растворах электролитов все реакции протекают между ионами. Так, С1 - - ионы ( хлорид-ион), входящие в состав всех хлоридов, образуют с Ag - noHaMH осадок хлорида серебра, а хлор, входящий в состав органического соединения ( например, хлороформа СНС13), в котором он не является ионом, этой реакции не дает. [50]
В водных растворах электролитов происходит гидратация ионов. [51]
В водных растворах электролитов в широкой области потенциалов на титане могут протекать самые разнообразные окислительно-восстановительные процессы. [52]
В водных растворах электролитов, насыщенных воздухом, на поверхности сурьмяного электрода идет образование оксидной пленки и некоторых других продуктов, например, HzOi [18], влияющих на потенциал электрода; поэтому непрерывное обновление раствора около рабочей поверхности электрода способствует установлению его потенциала. [53]
Страницы: 1 2 3 4