Растворение - железо
Cтраница 2
Процесс растворения железа в хлорной воде достаточно сложен, так как он идет с образованием, вследствие гидролиза, значительного количества гидроокиси железа в коллоидном состоянии. Коррозия железа в кислых растворах и в присутствии окислителей, ускоряющих образование ржавчины, проходит значительно скорее, чем в чистой воде. Стендер считает, что сущность растворения железа в хлорной воде сводится к действию сильных кислот, особенно соляной кислоты, получающейся в хлорной воде вследствие гидролиза хлора. [16]
Скорость растворения железа в разбавленных растворах кислот можно резко снизить, добавляя к кислоте отрицательный катализатор - ингибитор. Ингибированные кислоты применяются для химической очистки изделий от ржавчины, так как ингибитор, не влияя на удаление ржавчины, предотвращает растворение в кислоте металла. Сильные ингибиторы, разработанные советскими учеными, обеспечивают хранение и перевозку 20-процентной соляной кислоты в стальных цистернах и баках. [17]
Скорости растворения железа определялись фотоколориметрически. На рис. 5 показано удовлетворительное совпадение результатов поляризационных и аналитических определений. [18]
Скорость растворения железа и углеродистых сталей в серной кислоте возрастает с увеличением ее концентрации, достигая определенного максимума; при дальнейшем увеличении концентрации кислоты скорость растворения резко уменьшается ( см. рис. 26, стр. [19]
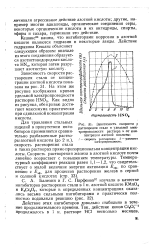 |
Зависимость скорости р растворения стали и удельной электропроводности раствора ч. от концентрации азотной кислоты. [20] |
Скорость растворения железа в азотной кислоте почти линейно возрастает с повышением температуры. [21]
Скорость растворения железа и углеродистых сталей в серной кислоте возрастает с увеличением ее концентрации, достигая определенного максимума; при дальнейшем увеличении концентрации кислоты скорость растворения резко уменьшается ( см. рис. 26, стр. [22]
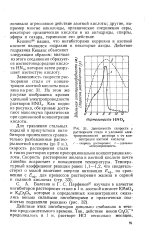 |
Зависимость скорости р растворения стали и удельной электропроводности раствора % от концентрации азотной кислоты. [23] |
Скорость растворения железа в азотной кислоте почти линейно возрастает с повышением температуры. [24]
Процесс растворения железа в - кислоте является типично катодно-анодным. [25]
 |
Состав окалины, образующейся при различной температуре. [26] |
При растворении железа происходит восстановление окиси железа Fe2O3 в закись железа FeO, которая легко растворяется в кислоте. На электрохимический характер процесса растворения окалины впервые указали Чапел и Эли38, обнаружившие ускорение процесса травления в растворах серной кислоты при соприкосновении стали, покрытой окалиной, с поверхностью чистого металла. [27]
При растворении железа и углеродистых сталей в азотной кислоте конечными газообразными продуктами реакции обычно являются окислы азота и наводороживание металла не происходит. [28]
 |
Состав окалины, образующейся при различной температуре. [29] |
При растворении железа происходит восстановление окиси железа Fe2O3 в закись железа FeO, которая легко растворяется в кислоте. На электрохимический характер процесса растворения окалины впервые указали Чапел и Эли38, обнаружившие ускорение процесса травления в растворах серной кислоты при соприкосновении стали, покрытой окалиной, с поверхностью чистого металла. [30]
Страницы: 1 2 3 4