Растворение - железо
Cтраница 3
При растворении железа и углеродистых сталей в азотной кислоте конечными газообразными продуктами реакции обычно являются окислы азота и наводороживание металла не происходит. [31]
При растворении железа в активном состоянии наличие в растворе ионов хлора не изменяет скорости коррозионного процесса. При температуре 300 С ионы хлора также препятствуют пассивации железа. [32]
При растворении железа в соляной кислоте роль окислителя выполняют ионы водорода. В отличие от хлора они могут окислить железо лишь до двухвалентного состояния. Прежде всего это связано со слабыми по сравнению с хлором окислительными свойствами ионов водорода. Кроме того, образующийся в результате реакции водород в момент выделения является сильным восстановителем и препятствует более глубокому окислению металла. Поэтому, если в кислотах растворение металла, проявляющего переменную валентность, сопровождается выделением водорода, в образующихся соединениях металл, как правило, проявляет низшую валентность. [33]
При растворении железа или стали в НС1 или H SO-i часть или весь фосфор улетучивается1 в виде фосфористого водорода, между тем как-азотная кислота окисляет весь фосфор в фосфорную кислоту. [34]
При растворении железа или стали в НС1 или H SO-i часть или весь фосфор улетучивается в виде фосфористого водорода, между тем как-азотная кислота окисляет весь фосфор в фосфорную кислоту. [35]
При растворении продажного железа в кислотах ( соляной, серной) выделяется водород с примесью небольших количеств углеводородов, сероводорода, фосфористого и кремнистого водорода, придающих галу неприятный запах; такое железо почти всегда оставляет нерастворимый остаток, состоящий большею частью из углерода. [36]
Пока идет растворение железа, приготовьте бюретки для марганцевокалиевой соли. [37]
Может служить растворение железа в нитратных, сульфатных и хлоратных электролитах. [38]
Чтобы предотвратить растворение железа в кислотах, к ним добавляют отрицательные катализаторы - ингибиторы. [39]
Уменьшение скорости растворения железа при повышении рН связано с образованием защитной пленки окислов железа, изолирующей металл от воды. [40]
Различие механизмов растворения железа и никеля, с одной стороны, и хрома, с другой, может быть связано с повышенным сродством хрома к кислороду. Возможно, что хемосорбция ионов ОН - на этом металле приводит к более полному заполнению ими поверхности с образованием более прочной связи. Имеются основания предполагать, что такие хемосорбционные слои могут не только ускорять, но и замедлять анодный процесс. Это следует прежде всего из результатов измерений скорости анодного растворения в условиях непрерывной механической зачистки поверхности. [41]
Исследования скорости растворения железа под полимерными пленками в атмосфере различной влажности показали, что привес образцов за вычетом абсорбированной в полимере влаги ( 6 месяцев) оказался ничтожно малым, а скорость коррозии при этом мало отличается от скорости растворения неизолированного металла. [42]
Для ускорения растворения железа вместе с кислотой приливают 0 5 мл хлористого олова ( 2) и ставят колбу на сильно нагретую плиту. [43]
Значительное торможение растворения железа было обнаружено [ 10, с. Измерения дифференциальной емкости медного электрода показали, что адсорбция производных тиокарбамида в большой области потенциалов превышает адсорбцию тиокарбамида. В сернокислом электролите, содержащем эти ПАВ, были получены прочно сцепленные осадки меди на стали. [44]
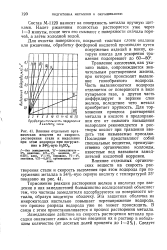 |
Влияние отдельных органических веществ на скорость растворения стали и выделения при этом водорода при погружении в 34о / о-ную H2SO4. [45] |
Страницы: 1 2 3 4