Растворение - железо
Cтраница 4
Торможение реакции растворения железа в кислотах при введении в них замедлителей большинство исследователей объясняет тем, что частицы замедлителя адсорбируются на поверхности металла, образуя защитную оболочку. Эта защитная оболочка на микрокатодах настолько повышает перенапряжение водорода, что процесс разряда водорода уже не может происходить. В связи с этим приостанавливается и процесс растворения металла. [46]
 |
Схема установки для получения железного коагулянта контактированием хлорной воды с железной стружкой. [47] |
Его получают растворением железа в серной кислоте с последующим упариванием ( до состояния насыщения) и кристаллизацией раствора. В настоящее время для получения железного купороса используют отходы травильных цехов и производства двуокиси титана. [48]
Если пренебречь растворением железа в меди до температуры 650 К, то относительная объемная концентрация суперпарамагнитной примеси nspVsp в меди до и после наноперехо-да одинакова. Следовательно, в соответствии с (3.37) суперпарамагнитные вклады при О К тоже одинаковы. [49]
В конце операции растворение железа ведут при подогреве растворов до 70 и периодической подаче воздуха для перемешивания. Процесс проводится в избытке азотной кислоты, но в конце реакции содержание последней уменьшают, добавляя к раствору измельченные железные стружки. [50]
Ионы РО1 замедляют растворение железа, способствуя образованию на нем малорастворимой фосфатной пленки. [51]
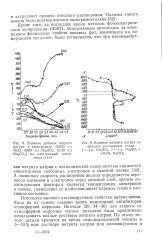 |
Влияние добавок нитрита натрия к электролиту ( 0 025 г / л NaCl. 0 057 г / л Na2S04. 0 164 г / л Na 2CO3 на электродный потенциал стали.| Влияние нитрита натрия на. [52] |
А поскольку скорость растворения железа определяется переносом катионов и электронов через окисный слой, причем лимитирующим фактором является концентрация электронов в пленке, уменьшение ее и обусловливает перевод стали в пассивное состояние. [53]
Так как скорость растворения железа в соляной кислоте значительно больше, чем в серной, процесс травления ведут при комнатной температуре или в слегка подогретой ванне, что предупреждает потери легко летучей кислоты. Соляная кислота значительно активней, чем серная, растворяет все три вида окислов железа, входящих в состав окалины. [54]
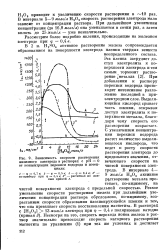 |
Зависимость скорости растворения. [55] |
Резкое уменьшение скорости растворения железа при дальнейшем увеличении концентрации раствора обусловлено, по-видимому, возрастанием скорости образования пассивирующейся пленки и тем, что она превышает скорость восстановления магнетита. [56]
Страницы: 1 2 3 4