Растворение - металл
Cтраница 2
Растворение металлов при катодной поляризации, Отч. [16]
Растворение металла из активного состояния приводит к выявлению граней с относительно плотной упаковкой атомов. Такая селективность растворения кристаллической решетки обусловлена тем, что атомы плоскостей с менее плотной упаковкой растворяются с большими скоростями вследствие того, что силы межатомной связи между ними в этом случае меньше, чем в плоскостях с плотной упаковкой. Такое влияние атомного строения на анодный процесс является, пожалуй, определяющим в развитии коррозии и особенно локальных коррозионных процессов. Развитие коррозионного процесса приводит к появлению на концевых ступеньках неполных атомных рядов активных частиц, обладающих гораздо более низкой свободной энергией активации растворения по сравнению с атомами, находящимися в нормальном положении. Это вызвано тем, что на концевых ступеньках неполных рядов, на неукомплектованных поверхностных плоскостях решетки содержатся атомы, менее прочно связанные с соседними атомами и более плотно окруженные молекулами растворителя. [17]
Растворение металлов в области активного состояния характеризуется линейной зависимостью между потенциалом Е и логарифмом плотности тока. [18]
Растворение металла, идущее одновременно с образованием Н2 из ионов Н в растворе, представляет собой случай, в котором анодный и катодный процессы протекают на одном и том же электроде. Эти процессы называются полиэлектродными. При этом как диффузия, так и химические процессы могут стать лимитирующими. Ранние работы по растворению амальгам натрия [76] в кислотах и основаниях указывают на то, что скорость реакции имеет первый порядок по Н и приблизительно порядок 1 / 2 по концентрации натрия. Для кислых растворов эти факты объяснялись тем, что процесс лимитируется диффузией. По-видимому, в этом случае лимитирующей стадией является перенос протона от молекулы недиссоциированной кислоты к поверхности металла, причем реакция подвергается специфическому катализу кислотами. При растворении солей, таких, как NaCl, в системах с перемешивающим устройством предполагается, что скорость реакции лимитируется диффузией, причем диффузия происходит через пограничный слой насыщенного раствора соли на поверхности кристаллов соли. Хотя подобная картина, по-видимому, является прарильной для простых солей, таких, как галогениды щелочных металлов, в случае солей металлов переменной валентности картина может быть другой. Так, например, безводный СгС13 очень медленно растворяется в воде, при этом скорость реакции не зависит от перемешивания. Было обнаружено, что небольшое количество Сг2 в растворе оказывает огромное влияние на скорость реакции. Вероятно, в этом случае осуществляется перенос заряда между частицами Сг2 в растворе и Сг3 в твердой фазе. Эти системы, по-видимому, заслуживают дальнейшего изучения. [19]
Растворение металла в области плато происходит в диффузионном режиме: подтверждением этого является то, что увеличение скорости перемешивания раствора приводит к соответствующему возрастанию тока в области участка ВГ. Толщина этого слоя увеличивается с повышением потенциала и области участка ВГ. Поверх слоя твердых продуктов реакции на аноде находится слой раствора с высокой концентрацией растворенных продуктов анодной реакции, так называемый вязкий слой. Растворение металла в диффузионном режиме приводит к преимущественному растворению микровыступов и сглаживанию шероховатости поверхности. Наличие анодной пленки на поверхности металла подавляет проявление структурной неоднородности поверхности и различия в скорости растворения различных микроучастков. Эти дна фактора и являются причиной полирования металла. [20]
Растворение металла продолжается примерно 30 мин. [21]
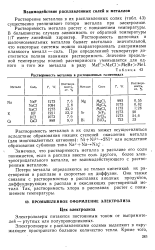 |
Растворимость металлов в расплавленных галогенидах. [22] |
Растворение металлов в их расплавленных солях ( табл. 43) существенно увеличивает потери металла при электролизе. [23]
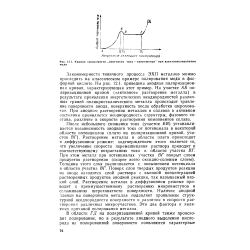 |
Кривая зависимости плотность тока - напряжение при электрополировании меди. [24] |
Растворение металла в области плато происходит в диффузионном режиме: подтверждением этого является то, что увеличение скорости перемешивания раствора приводит к соответствующему возрастанию тока в области участка ВГ. Толщина этого слоя увеличивается с повышением потенциала в области участка ВГ. Поверх слоя твердых продуктов реакции на аноде находится слой раствора с высокой концентрацией растворенных продуктов анодной реакции, так называемый вязкий слой. Растворение металла в диффузионном режиме приводит к преимущественному растворению микровыступов и сглаживанию шероховатости поверхности. Наличие анодной пленки на поверхности металла подавляет проявление структурной неоднородности поверхности и различия в скорости растворения различных микроучастков. Эти два фактора и являются причиной полирования металла. [25]
Растворение металлов в области активного состояния характеризуется линейной зависимостью между потенциалом Е и логарифмом плотности тока. [26]
Растворение металла приводит к разрушению электрода. [27]
Растворение металлов в их расплавленных солях в основном обусловлено образованием нестойких соединений низшей валентности ( субсоединений, например, CaCl, BaCl и др.) и в незначительном количестве в виде металлической дисперсной фазы типа коллоидного раствора. [28]
Растворение металлов в кислотах может происходить как с кислородной, так и водородной деполяризацией. Разряд водорода на поверхности металла приводит к наводораживанию его. [29]
Растворение металла при повышенной температуре способствует, с одной стороны, ускорению процесса, с другой - коагуляции осадка гидроокиси лития, образуемой за счет реакции металла или амида со следами воды в растворителе. Благодаря этому отделение осадка фильтрованием не представляет труда. [30]
Страницы: 1 2 3 4