Активное растворение - металл
Cтраница 4
Как видно из рис. ПО, при увеличении анодной поляризации растет плотность анодного тока. Скорость анодного процесса начинает снова возрастать лишь после потенциала Ецп, при котором начинается новый процесс, например выделение кислорода. В области А В происходит активное растворение металла, в области ВС - пассивирование металла и падение скорости процесса, область CD - пассивное состояние металла, при котором скорость анодного растворения очень мала, и в области DE протекает новый анодный процесс. Причиной пассивации металлов является адсорбция кислорода, образование оксидных пленок на поверхности металла или действие обоих факторов. [46]
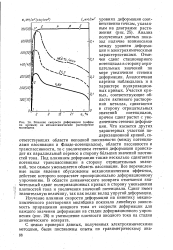 |
Влияние скорости деформации ( цифры на кривых на механохимическое растворение молибдена. [47] |
Отмечен сдвиг стационарного потенциала в сторону отрицательных значений по мере увеличения степени 0 2 деформации. Участки кривых, соответствующие области активного растворения металла, сдвигаются в сторону отрицательных значений потенциалов, причем сдвиг растет с увеличением степени деформации. Что касается других характерных участков поляризационной кривой соответствующих области неполной пассивности ( между потенциалами пассивации и Фладе-потенциалом), области пассивности и транспассивности, то с увеличением степени деформации происходит их параллельный перенос в сторону больших значений плотностей тока. Под влиянием деформации также несколько сдвигается потенциал транспассивации в сторону отрицательных значений, тем самым уменьшается область пассивации. Все перечисленные выше явления обусловлены механохимическим эффектом, действие которого возрастает пропорционально деформационному упрочнению. В области динамического возврата отмечается значительный сдвиг поляризационных кривых в сторону уменьшения плотностей тока и увеличения значений потенциала. Сдвиг имеет значительную величину, так как велик вклад упругой деформации. [48]
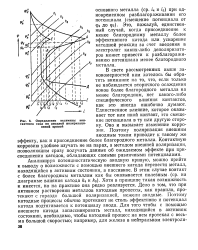 |
Определение величины контактного тока по анодной поляризационной кривой. [49] |
Анализируя потенциостатическую анодную кривую, можно прийти к выводу о возможности с помощью внешнего катода перевести металл, находящийся в активном состоянии, в пассивное. В этом случае контакт с более благородным металлом как бы оказывается полезным ( ср. Хотя в принципе такая возможность и имеется, но на практике она редко реализуется. Дело в том, что при активном растворении металлов катодные процессы, как правило, протекают с гораздо большей поляризацией, нежели анодные. Поэтому катодные процессы обычно протекают не столь эффективно и потенциал катода подтягивается к потенциалу анода. [50]
 |
Потенциостатическая поляризационная кривая анодного растворения металла, способного пассивироваться. [51] |
При помощи потенциостатического метода измеряют также зависимость тока от потенциала электрода. Если раньше анодного выделения кислорода наступает вновь растворение металла, то область IV называется областью перепассивации или транспассивности. Механизмы растворения металла в активной области и в области перепассивации могут отличаться. При отклонении от Фладе-потенциала в катодную сторону начинается активное растворение металла. [52]
На рис. 190 представлена зависимость количества возникающих на поверхности точечных анодов и их глубины от плотности анодного тока. Эта зависимость в логарифмических координатах описывается уравнением прямой с показателем степени п 1, что указывает на наличие прямой пропорциональности между числом возникающих питтингов и плотностью тока. Это является результатом того, что металл в большинстве питтингов пассивируется и они со временем перестают функционировать. Проявляется двойственная роль анодной поляризации; в одних центрах она способствует активному растворению металла, в других - пассивированию поверхности. В активном состоянии остается лишь небольшое число активных центров, в которых, очевидно, не был достигнут ток пассивации. [53]
На рис. 190 представлена зависимость количества возникающих на поверхности точечных анодов и их глубины от плотности анодного тока. Эта зависимость в логарифмических координатах описывается уравнением прямой с показателем степени п - I, что указывает на наличие прямой пропорциональности между числом возникающих питтингов и плотностью тока. Это является результатом того, что металл в большинстве питтингов пассивируется и они со временем перестают функционировать. Проявляется двойственная роль анодной поляризации; в одних центрах она способствует активному растворению металла, в других - пассивированию поверхности. В активном состоянии остается лишь небольшое число активных центров, в которых, очевидно, не был достигнут ток пассивации. [54]
На коррозионную стойкость алюминия влияет кислород, растворенный в воде. В деаэрированной воде потенциал коррозии алюминия отвечает пассивному состоянию. При увеличении концентрации кислорода в воде до 8 - 10 мг / л, что соответствует насыщению воды воздухом, потенциал коррозии алюминия увеличивается, но остается в пределах пассивной области, т.е. скорость коррозии не изменяется. В аэрированных же растворах с большой концентрацией хлорид-ионов ( 0 01 моль / л и выше) значения потенциала коррозии алюминия находятся в пределах области активного растворения металла. Очевидно, что увеличение концентрации кислорода должно привести к интенсификации катодных процессов, возрастанию потенциала коррозии алюминия и скорости анодного растворения металла в активном состоянии. Так, увеличение парциального давления кислорода с 0 1 до 2 3 МПа приводит к возрастанию скорости коррозии чистого металла ( 99 00 %) в речной воде. [55]
Классические поляризационные кривые приведены на рис. У. При этом течет отрицательный электрический ток, складывающийся из малого тока восстановления ионов кислорода и большого тока восстановления ионов водорода. Этот суммарный ток всегда отрицательный. Его протекание повышает электрический потенциал. По абсолютной величине этот ток невелик. Анодный ток, соответствующий анодному растворению, по абсолютной величине равен катодному току, а потенциал, отвечающий такому состоянию, является потенциалом коррозии. Анодный электрический ток ( ток коррозии) пропорционален скорости коррозионного растворения. Он-возрастает с увеличением потенциала. Диапазон потенциалов, соответствующий активному растворению металла, называется областью активного состояния. [57]
Страницы: 1 2 3 4
