Активное растворение - металл
Cтраница 2
С ( рис. 1) показывает, что образование окисных пленок на титане при анодной поляризации должно происходить даже в области потенциалов, отвечающих активному растворению металла. Таким образом, нельзя связать начало пассивирования титанового анода с достижением потенциала реакции образования какого-либо из его окислов. [16]
 |
Область МКК для чувствительной к. [17] |
Эти наблюдения были проанализированы Франсом и Грином [165], которые считают, что этот пик образуется благодаря растворению Ni, накапливающегося на поверхности во время активного растворения металла при болез низких потенциалах. Клербойс [164] также отмечал, что при выдержке чувствительного к МКК образца при потенциале 0 14 В в 1 0 моль / дм3 Нг5О4 в течение 24 ч дальнейшие испытания на изгиб показывают изломы и трещины. Как видно из рис. 10.16, при этом потенциале обедненные хромом границы зерен будут корродировать активно, в то время как матрица будет находиться в пассивном состоянии. По-тенциостатические испытания, в которых для обнаружения МКК используют метод изгиба, похожи на испытания в кислых растворах сульфата меди. [18]
При воздействии совершенно безводных кислых спиртовых растворов или растворов органических кислот на коррозионно-стойкие стали, Mg, Al, Pb, CiyTi; Fe или его сплавц происходит активное растворение металла. [19]
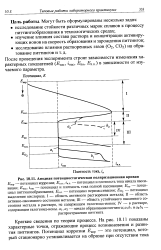 |
Анодная потенциостатнческая поляризационная кривая. [20] |
Епас, пас - потенциал и плотность тока полной пассивации; Ет - потенциал питтингообразования; Е, , - потенциал перепассивации; Ео2 - потенциал выделения кислорода. I - область активного растворения металла; II - область активно-пассивного состояния металла; III - область устойчивого пассивного состояния металла в растворе, не содержащем галогенид-ионов; IV - в растворе, содержащем галогенид-ионы. [21]
Если разрушение обусловлено ( водородной хрупкостью, то катодная поляризация, которая приводит к восстановлению и выделению водорода на поверхности металла, должна спосо бство-вать проникновению водорода в металл и ускорять разрушение. Если же КР обусловлено активным растворением металла в щели, то катодная поляризация должна за счет эффекта электрохимической защиты замедлять разрушение или полностью его приостанавливать. [22]
При фазовых превращениях одна фаза может перейти в другую или вследствие возникновения зародышей новой фазы, или, если процессы связаны с растворением металла, - путем образования пустотных зародышей. Пустотные зародыши образуются в центрах активного растворения металлов, в местах нарушения кристаллической решетки. [23]
Цвет оксидной пленки изменяется в зависимости от состава сплава. Повышение концентрации уксусной кислоты способствует активному растворению металла, а введение бихромата калия - его пассивированию. Увеличение концентрации уксусной кислоты свыше 8 мл / л сопровождается ухудшением качества пленки, при концентрации ее ниже 5 мл / л на поверхности металла образуется желто-зеленый налет. [24]
В качестве вспомогательного электрода обычно используют платиновую проволоку. Поскольку скорость электрохимического процесса в области активного растворения металла может быть весьма велика, для уменьшения омического падения потенциала ( особенно это важно для растворов с малой проводимостью) желательно использовать электрод сравнения, снабженный капилляром Луггина. Собственно электродом сравнения может быть каломельный, хлорсеребряный, водородный в том же растворе или любой другой. [25]
Как видно на коррозионной диаграмме ( рис. 10.7), кривая анодного растворения металла состоит из нескольких участков. На первом участке ( АВ) происходит активное растворение металла. [26]
 |
Скорость коррозии титана и его сплавов в растворах хлоридов при 100 С. [27] |
С другой стороны, если продолжить сравнение поведения титана в подкисленных растворах бромидов и хлоридов, то нетрудно убедиться в том, что активное растворение титана в растворах хлоридов протекает с несоизмеримо большими скоростями, чем в растворах бромидов. В соответствии с представлениями, развитыми школой Я. М. Колотыркина [332], при активном растворении металлов в процессе ионизации принимают участие как ОН - - ионы, так и другие анионы. Поэтому такие резкие различия в скоростях ионизации титана в растворах хлоридов и бромидов могут быть объяснены только тем, что С1 - - ионы и адсорбируются легче и образуют более прочные комплексы с атомами титана, чем Вг - - ионы. Отсюда следует, что С1 - - ионы должны не только ускорять активное растворение титана, но и облегчать процессы активации. Действительно, сопоставление устойчивости титана к активации в растворах хлоридов и бромидов, как общей, так и локальной ( см. дальше), показывает, что титан значительно более устойчив в растворах бромидов. [28]
Максимальная плотность тока, при которой начинается пассивирование, может быть повышена введением в раствор активаторов анодного растворения, например ионов С1 -, которые хорошо адсорбируются металлом и вытесняют кислород. Поэтому применение растворов, содержащих ионы С1 -, позволяет повысить скорость активного растворения металла. [29]
Этот вид разрушения называют обычно1 водородной хрупкостью. Другой вид - это КР в обычном понимании, которое возникает за счет активного растворения металла в вершине трещины. [30]
Страницы: 1 2 3 4