Растворимость - иод
Cтраница 4
Растворы иода в воде имеют красно-коричневый цвет. В присутствии галоидных солей растворимость иода в воде возрастает вследствие образования комплексных полииодид-ионов. Больше всего растворимость иода повышается в присутствии йодистых солей, несколько меньше в присутствии бромистых солей, а в присутствии хлористых солей растворимость иода увеличивается в наименьшей степени. Раствор имеет фиолетовый цвет. При разбавлении кислоты водой до 42 % раствор становится коричневым. Иод хорошо растворяется в жидких неорганических галогенидах, а также в расплавленных йодистых солях. В жидкой двуокиси серы иод растворяется, диссоциируя на ионы. Растворы иода в жидкой двуокиси серы используют для определения влаги в органических жидкостях. [46]
Оставить одну пробирку для сравнения, во вторую пробирку прилить раствор йодистого калия и сильно взболтать. Образованием какого вещества объясняется увеличение растворимости иода. [47]
Как и почему изменяется при этом растворимость иода. [48]
Для растворения иода целесообразно брать 3 - 4-кратный против эквивалентного количества избыток иодида калия. Такой избыток необходим, чтобы увеличить растворимость иода; кроме того, летучесть иода в растворах с высокой концентрацией иодида калия значительно меньше по сравнению с лету-г честью твердого иода, в результате чего практически устраняется одна из основных причин погрешностей при иодометрических определениях. [49]
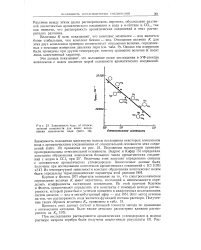
На рис. VI 1 8 изображена зависимость от температуры растворимости иода в разных растворителях. Из рисунка видно, что величины растворимости иода в разных растворителях различаются в десятки, а по данным табл. VII, 7 - в сотни раз; такое различие удовлетворительно предсказывается теорией регулярных растворов. [50]
На рис. VII, 8 изображена зависимость от температуры растворимости иода в разных растворителях. Из рисунка видно, что величины растворимости иода в разных растворителях различаются в десятки, а по данным табл. VII, 7 - в сотни - раз; такое различие удовлетворительно предсказывается теорией регулярных растворев. [51]
 |
Зависимость гмакс от относительной основности для полос поглощения комплексов иода ( 10. [52] |
Кортюм и Фогель [97] обратили внимание на то, что спектроскопическое определение величин К имеет недостаток, состоящий в невозможности определить коэффициенты зкстинкции комплексов. Этот метод основан на том, что растворимость иода является функцией состава раствора. [53]
Они образуются при кристаллизации простых галогенидов в присутствии избытка галогена или соответствующего межгалогенного соединения. Обычным примером образования полигалогенида является значительное увеличение растворимости иода в воде при добавлении иодид-ионов. [54]
Страницы: 1 2 3 4