Растворимость - образующийся осадок
Cтраница 3
Нейтральный раствор соли двухвалентной ртути можно титровать цианидом калия, применяя в качестве индикатора фенолфталеин до появления красного окрашивания последнего. Для таких титрований можно всегда подобрать подходящий индикатор, рассчитав предварительно кривую титрования. Изменения величины рН во время титрования вычисляют по константе ионизации той слабой кислоты ( или слабого основания), соль которой применяют в качестве титрующего реактива, и по произведению растворимости образующегося осадка или по константе ионизации получающегося мало диссоциированного соединения. Более общим случаем является титрование одного иона другим в присутствии индикатора, с которым тот или иной из этих ионов образует окрашенное вещество. Для получения хороших результатов в этих случаях необходимо, чтобы в точке эквивалентности или очень близко от нее концентрация исчезающего из раствора иона стала настолько незначительной, чтобы этот ион перестал давать окраску с индикатором, или же чтобы самая малая концентрация кона реактива ( прибавляемого в избытке) была достаточной для реакции с индикатором. Хорошо известным примером является применение соли трехвалентного железа в качестве индикатора при титровании роданидов солью серебра в кислом растворе. Роданид серебра так мало растворим, что он не дает достаточного количества ионов CNS - для реакции с ионами Fe444 в растворе, но в присутствии даже самого малого избытка ионов CNS - раствор окрашивается в красно-коричневый цвет. [31]
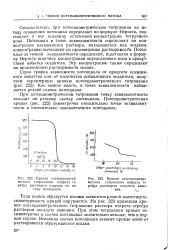 |
Кривая потенциометрического титрования нитрата серебра раствором хлорида по методу осаждения.| Кривая потенциометрн ческого титрования нитрата серебра раствором оксалата аммония. V. [32] |
Если осадок образуется ионами элементов разной валентности, симметричность кривой нарушается. На рис. 223 приведена кривая потенциометрического титрования раствора нитрата серебра раствором оксалата аммония. При этом титровании кривая несимметрична и скачок потенциала значительно меньше, чем в первом случае. Величина скачка потенциала зависит прежде всего от растворимости образующегося осадка. [33]
Метод основан на том, что рабочий раствор с определяемым ионом образует прочное внутрикомплексное соединение, которое большей частью растворимо в воде. Концентрация определяемого иона по мере титрования будет уменьшаться, так как все больше и больше ионов связывается в комплекс. Таким образом, комплексообразование аналогично осаждению, хотя при комплексообразовании выпадение осадка не обязательно. Осаждение происходит тем полнее, чем меньше растворимость образующегося осадка. [34]
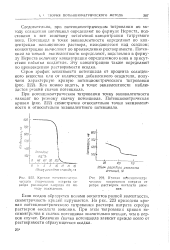 |
Ктшпзя п (. геш. иометр.. ческою титрования нитрата серебра раствором оксалата аммония. [35] |
Если осадок образуется ионами элементов разной валентности, симметричность кривой нарушается. На рис. 223 приведена кривая потенциометрического титрования раствора нитрата серебра раствором оксалата аммония. При этом титровании кривая несимметрична и скачок потенциала значительно меньше, чем в первом случае. Величина скачка потенциала зависит прежде всего от растворимости образующегося осадка. [36]
При потенциометрическом титровании эквивалентная точка находится по резкому скачку потенциала. Потенциометрическая кривая, изображенная на рис. 137, симметрична относительно эквивалентной точки и относительно эквивалентного потенциала. Если осадок образуется ионами разной валентности, симметричность кривой нарушается. На рис. 138 приведена кривая потенциометрического титрования азотнокислого серебра оксалатом с образованием осадка щавелевокислого серебра. Как видим, при этом титровании кривая несимметрична и скачок потенциала значительно меньше, чем в первом случае. Величина скачка потенциала зависит прежде всего от растворимости образующегося осадка. [37]
Страницы: 1 2 3