Протонный растворитель
Cтраница 3
В протонных растворителях, реакция протекает по существу через тот же самый интермедиат, который участвует в реакций Тиффено - Демьянова, Так как продуктом реакции является также кетон, то последующее присоединение диазометана может привести к высшим гомологам. Наи-лучщйе выходы получают тогда, когда исходный кетоа более активен, чем продукт реакции, поэтому реакция идет хорошо в случае напряженных кетонов. Было обнаружено: что реакция ускоряется спиртовыми растворителями. [31]
В протонных растворителях с большим значением Ля этот процесс сильно ускоряется, так как они способны сольватировать анионы Х - с образованием водородных мостиков. [32]
В протонных растворителях кислород фенолятного иона ( как атом с наибольшей электронной плотностью) специфически соль-ватируется ( см. раздел 5.3.2) за счет ион-дипольного взаимодействия и образования прочных водородных мостиков. Его нуклеофильность снижается так сильно, что становится возможным С-алкилирование. Таким образом, благодаря выбору подходящего растворителя, можно осуществить менее выгодное в других условиях С-алкилирование фенола. [33]
В протонных растворителях, реакция протекает по существу через тот же самый интермедиат, который участвует в реакции Тиффено - Демьянова, Так как продуктом реакции является также кетон, то последующее присоединение дназометана может привести к высшим гомологам. Нан-лучщйе выходы получают тогда, когда исходный кетон более активен, чем продукт реакции, поэтому реакция идет хорошо в случае напряженных кетонов. Было обнаружено, что реакция ускоряется спиртовыми растворителями. [34]
В протонных растворителях анионы сольватируются путем взаимодействия ион-диполь, на которое накладывается образование сильной водородной связи, больше всего проявляющееся для анионов малого радиуса. В диполярных апротон-ных растворителях анионы сольватируются путем взаимодействия ион-диполь, на которое накладывается взаимодействие, обусловленное взаимной поляризуемостью аниона и молекулы растворителя, сильнее всего сказывающееся для больших анионов. [35]
В протонных растворителях пара хинон ( 21) - гидрохинон ( 22) является классическим примером быстрой ( обратимой) системы Потенциалы полуволны для хинона, таким образом, обладают термодинамически определенным значением и очень хорошо коррелируют с окислительно-восстановительными потенциалами, определенными другими методами [60], например по-тепциометрическим. Образующийся при одиоэлектронном восстановлении беизохинона ( 21) в щелочной среде промежуточный беизосемнхиион-анион ( 23) был уже давно известен [61]; анион-радикал ( 23) может претерпевать радикальную димери-зацию, переходя в хингидрои, или диспропорционировать на хинон и гидрохинон. [36]
В водных и других протонных растворителях ( например, NH3, CH3COOH) теория Бренстеда-Лоури объясняет много реакций взаимодействия ионов, протекающих с участием растворителя. Но возможны и реакции в расплавленных солях при повышенной температуре. [37]
Этанол - протонный растворитель, подобный воде и муравьиной кислоте. Однако в то время, как вода и муравьиная кислота являются хорошими растворителями для 8м1 - реакций, этанол чаще всего используют как растворитель для 8м2 - реакций. [38]
Так как обычно протонный растворитель присутствует в большом избытке, его участие в реакции нельзя обнаружить при помощи кинетических измерений. Если, однако, реакцию проводить в относительно инертном растворителе ( бензол, ССЦ), то легко можно заметить эффект, который вызывает добавление небольшого количества протонного растворителя. Например, реакция между бромистым метилом и пиридином в бензоле ускоряется при добавлении небольших количеств спиртов или фенолов [44] и, как и следовало ожидать, тем сильнее, чем кислее добавленный протонный растворитель и, тем самым, больше его способность к образованию водородных мостиков. [39]
Даже для протонных растворителей это более широкое и более полезное определение, поскольку оно позволяет понять, почему кислый или основной характер не есть абсолютное свойство растворенного вещества. Вернее наоборот, кислый или основной характер вещества можно определить лишь в связи с используемым растворителем. [40]
Переход от протонных растворителей к апротонным биполярным приводит к значительной десольватации гидроксил-аниона и росту его основности. [41]
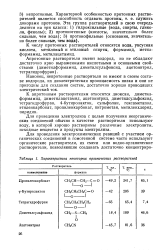 |
Характеристика некоторых органических растворителей. [42] |
К числу протонных растворителей относятся вода, уксусная кислота, метиловый и этиловый спирты, формамид, метил-формамид, метилацетамид. [43]
Из числа протонных растворителей для большинства реакций используется аммиак, так как он в основном удовлетворяет уже перечисленным требованиям, а кроме того, его легко очищать и удалять после реакции. Однако аммиак имеет и недостатки, к которым относится низкая температура кипения ( - 33 С), вследствие чего работы с ним необходимо проводить при очень низких температурах. Помимо этого, в жидком аммиаке трудно выполнять количественные исследования, такие, например, как определение квантового выхода. [44]
В отсутствие протонного растворителя 39 теряет N2 и происходит миграция водорода, приводящая к олефиновому продукту. Миграция водорода может либо сразу следовать за потерей N2, либо происходить одновременно с ней. [45]
Страницы: 1 2 3 4