Амфотерной растворитель
Cтраница 2
Вода является амфотерным растворителем, так как диссоциирует с образованием катионов гидроксония и анионов гидроксила в равных количествах. [16]
Спирты являются амфотерными растворителями. [17]
Вода является типичным амфотерным растворителем. [18]
Отношение ионного произведения амфотерных растворителей к константам диссоциации оснований КуК0б втак же, как и отношение ионного произведения к константам диссоциации кислот / К0б изменяется мало. [19]
Не следует смешивать классификацию: основные, кислые и амфотерные растворители с классификацией: нивелирующие и дифференцирующие растворители - Это - классификации растворителей по различным признакам. [20]
Если кислотные и основные свойства амфотерного растворителя резко выражены, то в нем сильные кислоты и сильные основания будут нивелированы. [21]
Аналогичные рассуждения применимы ко всем амфотерным растворителям. Влияние растворителей на силу кислот и оснований графически представлено на рис. 30, где изображены границы областей кислотности и щелочности в некоторых растворителях. [22]
Причину понижения силы электролитов в амфотерных растворителях по сравнению с водой можно назвать уверенно: более низкая, чем в воде, диэлектрическая проницаемость. Но поскольку ДП метанола почти в 2 5 раза меньше, чем у воды, кислоты в нем существенно ослаблены по сравнению с водой. [23]
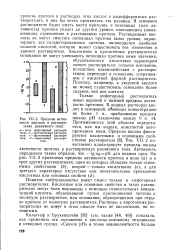 |
Пределы активности протона в растворителях различного типа. [24] |
Понятие нейтральность имеет смысл только в амфотерных растворителях. Кислотные или основные свойства в таких растворителях могут быть выражены с помощью относительных концентраций кислоты, образованной путем присоединения протона к молекуле растворителя, или основания, образующегося при отрыве протона от молекулы растворителя. Растворы в апротонных растворителях не морут в этом смысле быть не кислотными, ни основными. [25]
И кислоты, и основания в амфотерных растворителях заметно более слабые электролиты по сравнению с водными растворами. [26]
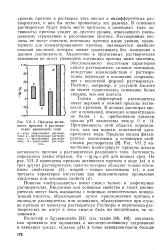 |
Пределы активности протона в растворителях различного типа. [27] |
Понятие нейтральность имеет смысл только в амфотерных растворителях. Кислотные или основные свойства в таких растворителях могут быть выражены с помощью относительных концентраций кислоты, образованной путем присоединения протона к молекуле растворителя, или основания, образующегося при отрыве протона от молекулы растворителя. Растворы в апротонных растворителях не могут в этом смысле быть ни кислотными, ни основными. [28]
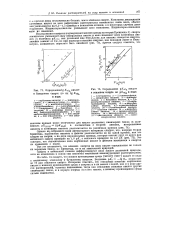 |
Определение lg йобА кислот.| Определение в этиловом спирте по. [29] |
Константы диссоциации катионных кислот во всех амфотерных растворителях изменяются очень мало, обычно они уменьшаются на 0 5 - 1 5 единицы в показателе степени, а в некоторых случаях даже возрастают. Индикаторы-кислоты уменьшают свои константы. Индикаторы-основания мало их изменяют. [30]
Страницы: 1 2 3 4