Амфотерной растворитель
Cтраница 4
Уравнения ( 9), ( 10) и другие подобные им соотношения, которые могут описывать не протекающие до конца реакции взаимодействия амфотерных растворителей со слабыми кислотами или основаниями, показывают, что кислотно-основное взаимодействие в растворителях этого типа зависит от кислотно-основной силы самого растворителя и от коэффициентов активности частиц, участвующих в протолитической реакции между растворенным веществом и растворителем. Поскольку многие из этих частиц обладают зарядом, диэлектрическая постоянная растворителя играет важную роль в определении положения равновесия рассматриваемого кислотно-основного взаимодействия. [46]
К, рК, К н, рА вн - Корреляции, подобные имеющимся между уравнениями (12.2), (12.3), (12.7) и (12.8), действительны и для любого другого амфотерного растворителя, однако значения Kawio неодинаковы для различных растворителей. [47]
Подводя общий итог всему изложенному выше, констатируем, что применение очень сильных основных и кислотных катализаторов, соответственно в протофильных и протогенных растворителях, позволяет ускорить реакции водородного обмена примерно до двадцати порядков по сравнению с их скоростью в амфотерных растворителях без катализатора. [48]
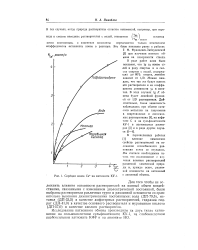 |
Сорбция ионов Cs на катионите КУ-1. анионный обмены. [49] |
Для того чтобы не осложнять влияния основности растворителей на ионный обмен воздействиями, связанными с изменением диэлектрической постоянной, были выбраны растворители различных групп и различной основности со сравнительно высокими диэлектрическими постоянными: вода ( ДП-795), метанол ( ДП-335) в качестве амфотерных растворителей, гидразин гидрат ( ДП-410) в качестве основного растворителя и муравьиная кислота ( ДП-570) в качестве кислого растворителя. [50]
Например: серная кислота - H2SO4, муравьиная кислота - НСООН, уксусная кислота - СН3СООН, метанол - СН3ОН и др. Основные растворители проявляют в отношении кислот про-тонно-акцепторные свойства, например: аммиак - NH3, гидразин - N2H4, пиридин - C5H5N и др. Амфотерные растворители проявляют свойства доноров протонов по отношению к основаниям и акцепторов протонов по отношению к кислотам. Например: вода - Н2О, этанол - С2Н5ОН, ацетон - СН3СОСН3 и др. Непроточные или инертные растворители или совсем не вступают в процессы кислотно-основного взаимодействия, или проявляют слабо кислотно-основные свойства. [51]
 |
Классификация растворителей ( по Бренстеду. [52] |
Кислые растворители относительно малочисленны. Амфотерные растворители часто подразделяют на кислые амфотерные и основные амфотерные, исходя из преобладающих свойств. [53]
Амфотерность - основное свойство большого числа растворителей - во многих случаях не обнаруживается. Амфотерные растворители представляют собой переходное звено между кислотными и основными растворителями. [54]
Страницы: 1 2 3 4