Апротонный растворитель
Cтраница 1
Апротонные растворители, например диметоксиэтан, делают предпочтительным разложение до карбена. [1]
Апротонные растворители представляют собой химические соединения инертного характера. Их молекулы не ионизированы. Они практически не отдают и не присоединяют протоны. Кислотно-основное равновесие в этих растворителях осуществляется почти полностью без их участия. [2]
Апротонный растворитель - растворитель, молекулы которого не содержат атом водорода, способный к образованию водородной связи или к взаимодействию с основанием. Примерами апротонных растворителей являются бензол, гексан, диметилсульфоксид. [3]
Апротонные растворители, не обладающие ни основными, ни кислотными свойствами, не проявляют себя как ионизирующие растворители по отношению к кислотам и основаниям Брен-стеда. Примерами таких растворителей являются бензол и че-тыреххлористый углерод. [4]
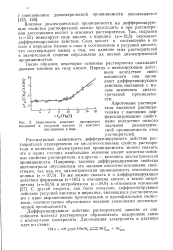 |
Зависимость констант оснований в уксусной кислоте диссоциации в воде. [5] |
Апротонные растворители являются растворителями с высокими дифференцирующими свойствами вследствие низкого значения диэлектрической проницаемости этих растворителей. Рассматривая зависимость дифференцирующего действия растворителей одновременно от кислотно-основных свойств растворителя и величины диэлектрической проницаемости, можно сказать, что в одних случаях наибольшее значение имеют кислотно-основные свойства растворителя, а в других-величина диэлектрической проницаемости. С другой стороны, как было показано, дифференцирующее действие уксусной кислоты и пиридина, являющихся растворителями с ярко выраженными протогенными и протофильными свойствами, соответственно обусловлено низкими значениями диэлектрической проницаемости. [6]
Апротонные растворители ( классы 4 и 8 по Бренстеду, табл. 1) образуют необычайно интересную группу, так как они по существу не обладают ни кислотными, ни основными свойствами. Поэтому взаимодействие между растворенными в них кислотами и основаниями не замаскировано реакциями с растворителем и проявляется наиболее отчетливо. В некоторых случаях вопрос о наиболее подходящей классификации растворителей остается неясным. [7]
Апротонные растворители представляют собой индивидуальные жидкости, характеризующиеся по сравнению с водой низким значением диэлектрической проницаемости и обладающие низким или нулевым дипольным моментом. Поэтому кислоты, основания и соли в них заметно не диссоциируют. Во многих апротонных растворителях хорошо растворяются неорганические и органические соединения, но кислотно-основное реагирование в их среде, в отличие т характера взаимодействия в протолитических растворителях происходит с участием слабых сил взаимодействия. [8]
Апротонные растворители, такие как гексан, циклогексан, бензол, толуол, тетрахлорид углерода и др., не вступают непосредственно в кислотно-основное взаимодействие с растворенным веществом, но тем не менее оказывают известное влияние на силу кислот и оснований, воздействуя на образование ассоциатов. Например, ассоциаты образуются между кислотами и анионами в процессе кислотно-основного титрования. [9]
Апротонные растворители, например диметилформамид и диметилсульфоксид, слабо стабилизируют анионы и поэтому не способствуют отщеплению X. Поскольку такие растворители не ослабляют основность нуклео-фильного агента из-за образования водородных связей, они представляют собой хорошую среду для бимолекулярного элиминирования. [10]
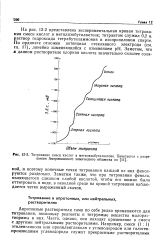 |
Титрование смеси кислот в метилиэобутилкетоне. Печатается с разрешения Американского химического общества из. [11] |
Апротонные растворители сами по себе редко применяются для титрования, поскольку реагенты и титруемые вещества малорастворимы в них. Часто, однако, они находят применение в смеси с другими нейтральными растворителями. [12]
Апротонные растворители не способны отщеплять протоны, поэтому для них невозможно определить константу кислоты. [13]
Апротонные растворители ( бензол, большинство углеводородов) - это вещества, которые или совсем не проявляют кислотные и основные свойства, или проявляют их очень слабо. Они не способны отдавать или принимать протоны. [14]
Апротонные растворители либо совсем не вступают в процессы протолитического ( кислотно-основного) взаимодействия с растворенным веществом, либо слабо проявляют кислотно-основные свойства. В их среде кислотно-основное равновесие осуществляется без заметного протонно-донорно-акцепторного участия молекул растворителя. [15]
Страницы: 1 2 3 4